
科目: 来源: 题型:
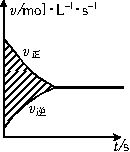
下图表示在容积固定的2L密闭容器中进行的某一可逆反应:A(g)+2B(g) 2C(g),以B的物质的量浓度改变表示的反应速率v逆、v正与时间的关系如下图所示。则图中阴影部分的面积可表示( )。
2C(g),以B的物质的量浓度改变表示的反应速率v逆、v正与时间的关系如下图所示。则图中阴影部分的面积可表示( )。
A.A的物质的量浓度的减少
B.B的物质的量浓度的减少
C.C的物质的量的增加
D.B的物质的量的减少
查看答案和解析>>
科目: 来源: 题型:
 内溶液中溶质的物质的量浓度(只写数值表达式,不用精确计算。假设溶质不能扩散到试管之外的水中)。
内溶液中溶质的物质的量浓度(只写数值表达式,不用精确计算。假设溶质不能扩散到试管之外的水中)。查看答案和解析>>
科目: 来源: 题型:
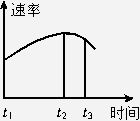
将除去氧化膜的镁条投入盛有稀盐酸的试管中,发现生成氢气的速率变化曲线如下图所示。在t1~t2时间段内生成氢气的速率逐渐增大,其原因是_________;而t2~t3时间段内生成氢气的速率逐渐降低,其原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
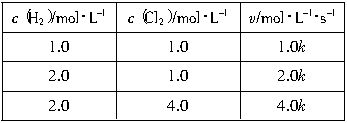
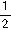 ,n=
,n=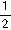
 ,n=1 D.m=1,n=
,n=1 D.m=1,n=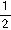
查看答案和解析>>
科目: 来源: 题型:
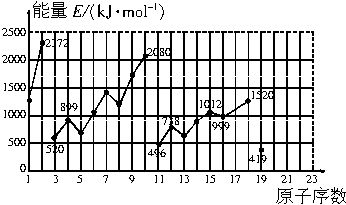
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
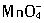 ,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com