
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
石墨和金刚石在一定条件下可相互转化:石墨?葑金刚石-Q(Q>0)。继美国通用汽车公司在实验室利用高温、高压(2000℃、20000atm)将石墨转化成金刚石之后,日本科学家用炸药和炭粉“炸出”金刚石的消息又引起了人们的广泛关注。他们将炸药和炭粉混合并用石蜡固化后装入钢制的敞口容器,沉入到一个直径为8m、深约5m的混凝土水槽内,点火起爆,最后将容器里的水取出静置,可获得直径为0.002μm~0.003μm的超细金刚石粉。
(1)从平衡移动原理分析,上述两种制取金刚石的方法之所以都能获得成功的原因是( )。
A.金刚石的熔点比石墨低
B.金刚石的密度比石墨大
C.金刚石硬度很大
D.合成金刚石是吸热反应
(2)炸药爆炸的瞬间,可以产生400000atm的超高压和5000℃的超高温,完全能达到将石墨转化成金刚石的条件,将炸药放在水槽内最主要的原因是( )。
A.形成高压条件 B.吸热降低温度
C.防止炭粉燃烧 D.溶解爆炸产生的气体
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的电池,人们普遍认为铝是负极。某研究性学习小组为探究该电池中究竟哪种金属作负极、发生了怎样的电极反应,进行了如下实验:
如图剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。
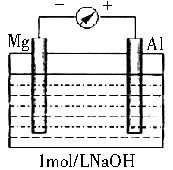
开始,电表指针向右偏转约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。
根据以上实验现象,回答下列问题:
(1)开始阶段,电池的正极是_______(填“Mg”或“Al”)片;铝片表面产生的气泡是______;负极发生的电极反应是______________________。
(2)随后阶段,铝片发生的电极反应式是_________________;镁条表面只有极少量的气泡产生,其原因是2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是____________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是__________。
查看答案和解析>>
科目: 来源: 题型:
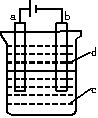
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验装置制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
(1)a电极材料应为_____________,电极反应式为___________。
(2)电解质溶液c可以是_________(填序号)。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为________,在加入苯之前对c应作何简单处理:______________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是_________(填序号)。
A.改用稀H2SO4做电解质溶液
B.适当增大电源的电压
C.适当减小两电极距离
D.适当降低电解质溶液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了在电极上看到气泡外,混合物中另一明显现象为________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 5Ca2++3PO43-+OH-。
5Ca2++3PO43-+OH-。查看答案和解析>>
科目: 来源: 题型:
如图所示,用a、b两惰性电极电解200mLCuSO4溶液,通电一段时间后,当a极的质量不再增加时,取出洗净干燥后,发现电极质量增加了6.4g。回答下列问题:
(1)标出电源的正负极。
(2)写出b极上发生的电极反应式以及溶液中总反应方程式。
(3)计算反应前CuSO4溶液的物质的量浓度以及反应后溶液中H+的浓度(不考虑溶液的体积变化)。
(4)反应完毕后加入_______可以使溶液与原溶液完全相同。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com