
科目: 来源: 题型:
某校化学小组同学利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3?6H2O晶体。(图中夹持及尾气处理装置均已略去)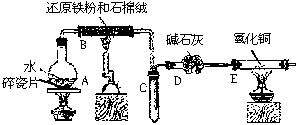
(1)装置B中发生反应的化学方程式是_________。
(2)装置E中的现象是_______________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:______________________________________。
(4)该小组同学利用上述滤液制取FeCl3?6H2O晶体,设计流程如下:
滤液 FeCl3溶液
FeCl3溶液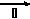 FeCl3?6H2O晶体
FeCl3?6H2O晶体
①步骤Ⅰ中通入Cl2的作用是_________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3?6H2O晶体的主要操作包括:________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)____________________________。
查看答案和解析>>
科目: 来源: 题型:
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两球的浮力变化)()。
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高

查看答案和解析>>
科目: 来源: 题型:
利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2 和Fe3+ 等可循环使用。
(1)写出电解池A、电解池B和光催化反应池中反应的离子方程式。
(2)若电解池A中生成3.36LH2(标准状况),试计算电解池B中生成Fe2+的物质的量。
(3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI的浓度分别为amol?L-1和bmol?L-1,光催化反应生成Fe3+的速率为cmol?min-1,循环系统中溶液的流量为Q(流量为单位时间内流过溶液的体积)。试用含所给字母的代数式表示溶液的流量Q。

查看答案和解析>>
科目: 来源: 题型:
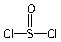 )中形成的,电池的电极总反应式是8Li+3SOCl2=6LiCl+Li2SO3+2S,下列关于这种新型电池的说法中错误的是()。
)中形成的,电池的电极总反应式是8Li+3SOCl2=6LiCl+Li2SO3+2S,下列关于这种新型电池的说法中错误的是()。查看答案和解析>>
科目: 来源: 题型:
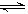 2NH3(g);ΔH<0。请根据图示回答下列问题:
2NH3(g);ΔH<0。请根据图示回答下列问题: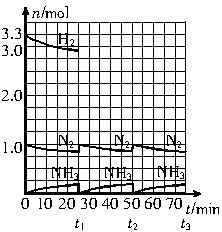
查看答案和解析>>
科目: 来源: 题型:
 Fe(OH)3(s)+3HCl(aq);ΔH>0
Fe(OH)3(s)+3HCl(aq);ΔH>0查看答案和解析>>
科目: 来源: 题型:
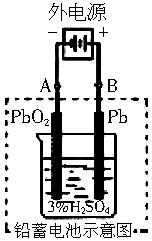
铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是_____________;电解质溶液中H2SO4的浓度将变_____;当外电路通过1mol电子时,理论上负极板的质量增加______g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池正负极的极性将_______。
查看答案和解析>>
科目: 来源: 题型:
 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述正确的是()。
Ni(OH)2。根据此反应式判断,下列叙述正确的是()。查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com