
科目: 来源: 题型:
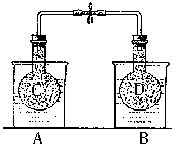 NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。
NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。 N2O4(g)
N2O4(g) 2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
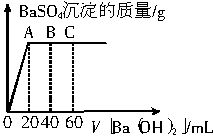
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 C(g);ΔH=-Q(Q>0)
C(g);ΔH=-Q(Q>0)查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
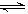 pC(g)+qD(g);ΔH<0,下列结论中不正确的是( )。
pC(g)+qD(g);ΔH<0,下列结论中不正确的是( )。查看答案和解析>>
科目: 来源: 题型:
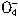 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O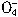 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O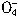 +______Fe2++______H+=______Mn2++_______Fe3++_______H2O
+______Fe2++______H+=______Mn2++_______Fe3++_______H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com