
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
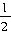 H2(g)+
H2(g)+ F2(g)=HF(g);ΔH=-269kJ?mol-1
F2(g)=HF(g);ΔH=-269kJ?mol-1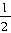 O2(g)=H2O(g);ΔH=-242kJ?mol-1
O2(g)=H2O(g);ΔH=-242kJ?mol-1查看答案和解析>>
科目: 来源: 题型:
IF5与卤素单质的性质相似,下列有关IF5的叙述正确的是( )。
A.IF5是由极性键形成的共价化合物
B.IF5分子中各原子均满足8电子结构
C.IF5有较强的还原性
D.IF5与H2O的反应属于非氧化还原反应时,其产物是HIO3和HF
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
不同卤素原子之间可以共用电子对形成卤素互化物,其通式为XYn(n=1、3、5、7),这种化合物易发生水解反应,如果3molBrFn与5molH2O恰好反应生成溴酸、氢氟酸、溴单质和O2,则下列叙述正确的是( )。
A.此卤素互化物的分子式为BrF3
B.此卤素互化物的分子式为BrF5
C.每摩尔BrFn完全反应时,可生成等物质的量的Br2和O2
D.BrFn的许多性质类似于卤素单质,有强还原性
查看答案和解析>>
科目: 来源: 题型:
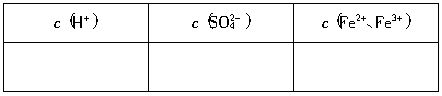
查看答案和解析>>
科目: 来源: 题型:
X-射线衍射法是通过X-射线衍射仪测出离子化合物中离子间的间隔,进而测出阿伏加德罗常数的值。已知: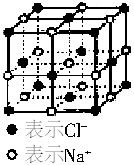 X-射线衍射仪测出的NaCl晶体中相邻Na+和Cl-的间距为2.819×10-8cm。相对原子质量为:Na:22.99,Cl:35.45。NaCl晶体模型如右图所示。
X-射线衍射仪测出的NaCl晶体中相邻Na+和Cl-的间距为2.819×10-8cm。相对原子质量为:Na:22.99,Cl:35.45。NaCl晶体模型如右图所示。
为了测定阿伏加德罗常数,某同学做了下列实验:用分析天平称取研细的一定质量的NaCl固体,装入25mL容量瓶中,然后用滴定管向容量瓶中滴加苯,并不断振荡,使苯和NaCl晶体充分混合,加至刻度。其实验数据记录于下表:
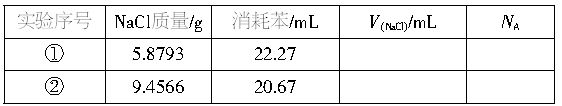
请根据实验数据填写出两次实验中未完成的空格(阿伏加德罗常数NA项只要求写出计算表达式)。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com