
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
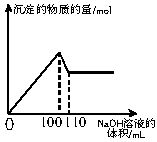
铁、铝合金1.39g完全溶于含有0.16molHNO3的热浓硝酸中(设反应中的硝酸不挥发,不分解),生成标准状况下VLNO2与NO的混合气体X及溶液Y。反应后向溶液Y中逐滴加入1mol/LNaOH溶液,生成沉淀的物质的量与滴入的NaOH溶液的体积关系如右图所示。试求:
(1)原合金中铁的质量分数是多少?
(2)V的数值为多少?气体X中NO2和NO的体积之比为多少?
查看答案和解析>>
科目: 来源: 题型:
(1)某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如下图所示),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验加以验证。
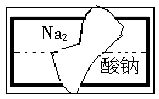
①猜想:这种试剂可能是___________________;
②简述验证的实验方案:____________________
_________________________________________________________________________________________。
(2)下列实验操作错误的是________(填编号)。
A.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴加边振荡,眼睛注视锥形瓶中溶液颜色的变化
B.用酸式滴定管量取0.10mol?L-1的Na2CO3溶液25.10mL
C.容量瓶检漏的操作:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水
D.做中和滴定实验时,锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
E.将滴管垂直伸进试管内滴加液体
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
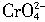 作指示剂,可见AgCl与Ag2CrO4相比,AgCl的溶解度要____(填“大”或“小”)。
作指示剂,可见AgCl与Ag2CrO4相比,AgCl的溶解度要____(填“大”或“小”)。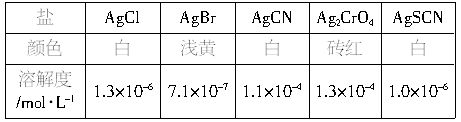
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com