
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
下表中有4组元素。在每组元素中,将0.02mol甲投入1L0.01mol?L-1的盐酸中,完全反应后,过滤,再向滤液(无损耗)中加入0.01mol乙,整个过程放出H2的量最多的组合是 ()。

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
对下图所示装置的叙述正确的是( )。
A.这是一个原电池的装置,铁为负极,铂为正极
B.这是一个电解氢氧化钠溶液的装置,铁为阴极,铂为阳极
C.铂为正极,其电极反应式为O2+2H2O+4e-=4OH-
D.铁为负极,其电极反应式为4OH--4e-=2H2O+O2↑

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
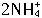 +2e-=2NH3↑+H2↑(NH3与Zn2+络合)。根据上面叙述判断下列结论正确的是( )。
+2e-=2NH3↑+H2↑(NH3与Zn2+络合)。根据上面叙述判断下列结论正确的是( )。查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com