
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
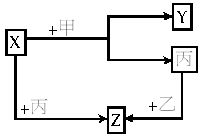
如下图所示,甲、乙、丙是三种常见的单质,X、Y、Z是三种常见的化合物。
(1)若甲是具有还原性的单质,X、Y、Z中只有一种是离子化合物,则:
①X、Y、Z中含有丙元素的是___________。
②乙的化学式是__________。
③X与甲反应的化学方程式为_______________。
(2)若甲是具有氧化性的单质,丙在通常情况下呈液态,Y和Z具有相同的阳离子,则X与足量的甲在溶液中完全反应的离子方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
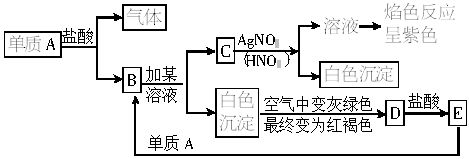
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
按右图所示装置进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_________容器中观察到白色沉淀,该实验涉及的化学方程式有____________。
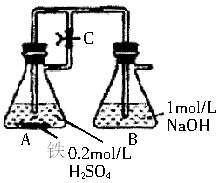
实验表明上述实验中出现的白色沉淀会逐渐转变为灰绿色或绿色,那么如何解释这种现象呢?
(1)甲同学查阅资料后,得到有关Fe(OH)2的信息如下表: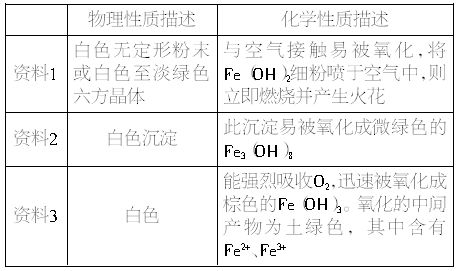
阅读资料后,你对上述实验中出现灰绿色或绿色现象的解释是_________;资料中提及的微绿色的Fe3(OH)8用氧化物的形式表示可写成:___________。
(2)乙同学依据配色原理,白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2?nH2O所致。用热水浴加热实验中生成的绿色沉淀,观察到沉淀的颜色有由绿变白的趋势。加热时,弹簧夹C应处于______(填“打开”或“关闭”)状态,容器A中的反应须处于______(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式:______________________________。
(3)请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀的颜色由白变绿的现象进行合理解释的实验设计新思路。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com