
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
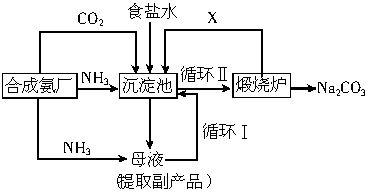
我国化工专学侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
(1)上述生产纯碱的方法称______,副产品的一种用途为__________。
(2)沉淀池中发生反应的化学方程式是___
_______________________________________。
(3)写出上述流程中X物质的分子式____。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是___________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_____________
_____________________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有__________。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com