
科目: 来源: 题型:
6.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A、甲、乙中都是铝过量 B、甲中铝过量、乙中碱过量
C、甲中酸过量、乙中铝过量 D、甲中酸过量、乙中碱过量
查看答案和解析>>
科目: 来源: 题型:
5.A、B两个烧杯中分别盛80 mL 3.0 mol·L-1的盐酸和氢氧化钠溶液,再分别加入等质量的铝粉,在相同状况下产生气体的体积比为A:B = 2:5,则加入铝粉的质量为( )
A.2.7g B.6.48g C.5.4g D.4.05g
查看答案和解析>>
科目: 来源: 题型:
7.由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是
A.锌 B.铁 C.铝 D.镁
查看答案和解析>>
科目: 来源: 题型:
向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A.NaCl Na2SO4 B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
查看答案和解析>>
科目: 来源: 题型:
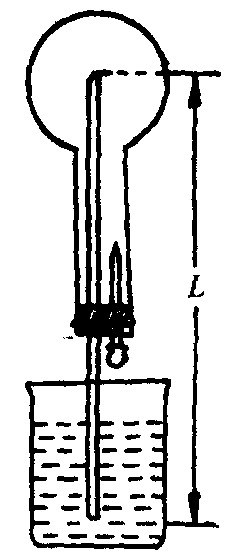
喷泉是自然界中的一种现象。在实验室中,利用气体和溶剂的某种性质,在一特定装置中,例如如右图装置,也能模拟这种现象。要能看到喷泉现象,则烧瓶和烧杯中应加入的物质为
A.HCl(H2O) B.CO2(H2O)
C.SO2(4mol/L NaOH溶液) D. NH3(汽油
查看答案和解析>>
科目: 来源: 题型:阅读理解
非金属知识规律总结
【高考导航】
一、非金属元素在周期表中的位置和结构特点
1、除H外,非金属元素均在“阶梯线”的右上方。共有16种非金属元素,其中包括稀有气体元素6种。
2、非金属元素(包括稀有元素)均在主族(零族)。非金属元素一般都有变价。
3、最外层电子数一般≥4(H、B除外)。
4、原子半径比同周期金属半径小(稀有元素除外)。
二、非金属性强弱的判断依据
元素非金属性的本质是元素的原子吸引电子的能力。试题常通过以下几个方面来比较元素的非金属性:
1、单质跟H2化合难易程度(反应条件,剧烈程度,反应热的大小,生成气态氢化物的稳定性)。
2、最高价氧化物对应水化物的酸性。
3、化合物中元素化合价的正负,如BrCl中,Cl为-1价,Br为+1价,说明非金属性Cl>Br。
4、通过氧化还原反应确定非金属单质的氧化能力,进而比较非金属性。
需要指出的是,非金属单质的活动性与非金属元素的活动性,有密切的联系,但不是一回事。例如氮元素的非金属性相当强,可是它的单质N2化学性质却不很活泼。单质的化学性质不仅取决于原子结构,而且取决于分子结构和晶体结构。
三、非金属元素的性质及递变规律
1、单质:
(1)结构:除稀有气体外,非金属原子间以共价键结合。非金属单质的成键有明显的规律性。若它处在第N族,每个原子可提供8-N个价电子去和8-N个同种原子形成8-N个共价单键,可简称8-N规则;(H遵循2-N规则)。如ⅦA族单质:x-x;H的共价数为1,H-H,第ⅥA族的S、Se、Te共价单键数为8-6=2,第ⅤA族的P、As共价单键数8-5=3。但第二周期的非金属单质中N2、O2形成多键。
(2)熔沸点与聚集态。它们可以分为三类:
①小分子物质。如:H2、O2、N2、Cl2等,通常为气体,固体为分子晶体。
②多原子分子物质。如P4、S8、As4等,通常为液态或固态。均为分子晶体,但熔、沸点因范德华力较大而比①高,Br2、I2也属此类,一般易挥发或升华。
③原子晶体类单质。如金刚石、晶体硅和硼等,是非金属单质中高熔点“三角区”,通常为难挥发的固体。
(3)导电性:非金属一般属于非导体,金属是良导体,而锗、硅、砷、硒等属于半导体。但半导体与导体不同之处是导电率随温度升高而增大。
(4)化学活性及反应:

③非金属一般为成酸元素,难以与稀酸反应。 固体非金属能被氧化性酸氧化。

2、氢化物:
(1)气态氢化物性质比较
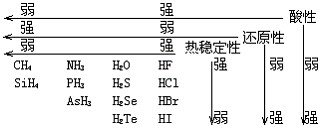
(2)由于氢键的存在,使得第ⅤA、ⅥA、ⅦA氢化物的熔沸点出现了反常。第ⅤA中:SbH3>NH3>AsH3>PH3;第ⅥA中: H2O>H2Te>H2Se>H2S;第ⅦA中HF>HI>HBr>HCl。
(3)气态氢化物水溶液的酸碱性及与水作用的情况。①HCl、HBr、HI溶于水成酸且都是强酸。②HF、H2S、H2Se、H2Te溶于水成酸且都是弱酸。③NH3溶于水成碱,氨水是弱碱。④PH3、AsH3、CH4与水不反应。⑤SiH4、B2H6与水作用时分解并放出H2。
3、非金属氧化物的通性:
(1)许多非金属低价氧化物有毒,如SO2、NO、NO2、CO等,注意不能随便排放于大气中。
(2)非金属氧化物(除SiO2外)大都是分子晶体,熔沸点相差不大。
(3)非金属氧化物大都为酸酐,相应的酸易溶于水,则氧化物易与水化合,反之水化反应难以进行。
(4)不成盐氧化物(如CO、NO)不溶于水,也不与碱反应。虽然NO2能与碱反应生成盐,但NO2不属于酸酐。
4、含氧酸
(1)同周期非金属元素最高价含氧酸从左到右酸性增强。
(2)氧化性:同种元素低价强于高价含氧酸.
如:HClO>HClO3>HClO4(稀)
H2SO3>H2SO4(稀)
HNO2>HNO3(稀)
(3)对于同种非金属形成的不同含氧酸,价态越高,酸性越强。其顺序如:HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3。
(4)难挥发的H2SO4、H3PO4受热难分解;强氧化性的HNO3、HNO2、HClO见光或受热易分解;非氧化性的H2CO3、H2SO3易分解。强酸可制弱酸,难挥发性酸制挥发性酸。
(5)常见含氧酸的一般性质:
①H2SO4:无色粘稠的油状液体,强酸,沸点高,不挥发,稳定。浓硫酸有吸水性、脱水性和强氧化性。
②H2SO3:仅存在于溶液中,中强酸,不稳定。
③HClO4:在水溶液中相当稳定,最强无机酸,有强氧化性。
④HClO:仅存在于溶液中,是一种弱酸,有强氧化性和漂白性,极不稳定,遇光分解。⑤HNO3:无色液体,强酸,沸点低,易挥发,不稳定,易分解,有强氧化性。
⑥H3PO4:无色晶体,中强酸,难挥发,有吸水性,稳定,属于非氧化性酸。
⑦H2CO3:仅存在于溶液中,弱酸,不稳定。
⑧H2SiO3:白色固体,不溶于水,弱酸,不挥发,加热时可分解。
⑨常见酸的酸性强弱。强酸:HCl、HNO3、H2SO4;中强酸:H2SO3>H3PO4(H3PO4中强偏弱);弱酸:HF>CH3COOH>H2CO3>H2S>HClO>H2SiO3。
四、11种无机化学气体的制取和性质(O2、H2、Cl2、CO、NO、SO2、NO2、CO2、H2S、HCl、NH3)。
(1)利用氧化还原反应原理制取的气体有:O2、H2、Cl2、NO、NO2等。
(2)利用复分解制取的气体有:SO2、CO2、H2S、HCl、NH3等。
(3)可用启普发生器制取的气体有:H2、CO2、H2S等。
(4)只能用排气法收集的是:Cl2、SO2、NO2、CO2、H2S、HCl、NH3等。只能用排水法收集的气体是:NO、CO。
(5)使红色石蕊变蓝的气体是NH3;使石灰水变浑浊的气体是SO2和CO2;使品红溶液褪色的气体是SO2和Cl2;使高锰酸钾溶液和溴水褪色的气体有H2S和SO2。
(6)臭鸡蛋气味的气体是H2S;刺激性气味的气体有:Cl2、SO2、NO2、HCl、NH3等;毒性气体有:Cl2、CO、NO、SO2、NO2、H2S等。
(7)能在空气中燃烧的气体:H2S、CO、H2等
查看答案和解析>>
科目: 来源: 题型:阅读理解
化学方程式练习
一、用化学方程式表示下列各种物质的实验室制法
1、O2(三种方法):
2、H2:
3、Cl2:
4、NH3:
5、CO2:
6、NO:
二、用方程式表示工业生产过程(参考选修Ⅱ,带*的写离子方程式,注意反应条件)
1、氯碱工业(电解饱和食盐水)
*阳极:
*阴极:
*总反应:
2、接触法制硫酸(硫铁矿为原料)
①沸腾炉: ;其中氧化产物为:
②接触室: ;
V2O5的作用是 ,反应温度控制在400~500℃的原因是
③吸收塔:
用98%H2SO4吸收SO3而不用水直接吸收的原因是
。
④尾气处理:
3、海水提溴:
*①氯化:
②吹出
③吸收:
④转化:
4、合成氨:
①由水和碳合成H2
②合成塔:
5、氨氧化制硝酸
①氧化炉:
②吸收塔:
③制取化肥硝酸铵:
6、冶炼铝(冰晶石作熔剂)
①碱溶:
②沉淀:
③脱水:
④电解:*阳极:
*阴极:
总反应:
7、铝热法制铁
8、由三氧化钨制钨
9、工业制漂白粉
10、制玻璃
11、工业生产石灰浆
12、联合制碱法:
13、高纯硅的生产
。
14、炼铁炼钢
①还原剂的生成:
;
②铁的还原(将铁的氧化物,如Fe2O3还原):
③将生铁脱硫去磷降低含碳量即得钢。
三、完成下列反应的化学方程式(注意写反应条件)。
1、Fe + H2O(g)=
2、C+ H2O(g) =
3、CO+ H2O(g) =
4、F2+ H2O=
5、NH3+H2O
6、NO2+ H2O=
7、SO2+ H2O
8、Cl2 + H2O=
9、K + H2O=
10、Na2O2+ H2O=
11、CaC2+ H2O=
12、Mg3N2+ H2O =
13、Al + NaOH+ H2O=
14、CaCO3+ H2O+ CO2=
15、Fe(OH)2+ H2O+ O2=
16、FeCl3+ H2O
17、NH4Cl+H2O
18、Na2CO3+H2O
19、CuSO4+H2O电解
20、Na2S2O3 + HCl =
21、SiO2 + HF=
22、SiO2 + NaOH=
23、Na2SiO3+ HCl=
四、写出下列物质分别与NaOH溶液反应的化学方程式。
1、Si
2、Cl2
3、SiO2
4、SO2 (足量)
5、CO2(小量)
6、H3PO4
7、H2SO4
8、CH3Br
9、Al
10、Al2O3
11、AlCl3
12、Al(OH)3
13、CuSO4
14、NaHCO3
15、Ca(HCO3)2(足量)
16、(NH4)2SO4
五、写出下列物质受热或光照的化学方程式。
1、NaHCO3
2、HNO3
3、AgBr
4、H2SO3
5、NH4HCO3
6、Cu(OH)2
7、Ca(HCO3)2
8、Cu2(OH)2CO3
9、H2O2
10、KClO3
11、KMnO4
12、NH4Cl
13、HClO
14、CH4+Cl2
15、H2+Cl2
16、CuO
六、写出下列反应的化学方程式和离子方程式
1、SO2使溴水褪色:
2、SO2使酸性高锰酸钾溶液褪色:
3、氢氧化铁溶于氢碘酸:
4、乙二酸(草酸)使酸性高锰酸钾溶液褪色 :
5、用石灰水与小苏打溶液制烧碱:
6、硫酸氢铵与氢氧化钡溶液混合:
7、漂白粉溶液中充入足量CO2:
8、KHSO4与氢氧化钡溶液混合呈中性:
9、Fe3O4溶于稀硝酸:
10、明矾溶液中加Ba(OH)2溶液至沉淀量最大:
七、用离子方程式表示下列在溶液中的反应
1、KCl+AgNO3:
2、Ba(OH)2+H2SO4:
3、BaCO3+HCl:
4、Cu(OH)2+HCl:
5、Fe(OH)2+HNO3(稀) :
6、FeCl3+KSCN:
7、FeBr2+Cl2(物质的量之比为1:1):
8、NaBr+Cl2:
9、Fe+CuCl2:
10、Zn+AgNO3:
11、纯碱水解:
12、明矾净水:
13、铜和稀硝酸:
14、配制银氨溶液:
15、Na2O2投入稀硫酸中:
八、写出下列物质在空气中变质的化学方程式
1、Na2SO3:
2、NaOH:
3、NO:
4、Na:
5、Na2O2:
6、铜生锈:
7、氯水:
8、白磷:
9、稀硫酸酸化的FeSO4溶液变棕黄色
10、无色KI溶液变棕黄色
11、漂白粉失效:
九、写出下列反应的化学方程式
1、混合H2S和SO2生成硫和水:
2、炭加热放入浓硫酸中:
3、乙醇催化氧化为乙醛:
4、乙醛与银氨溶液反应:
5、乙醛与新制Cu(OH)2加热:
6、铜与浓硫酸共热:
7、氧化硫通入浓溴水:
8、铜与浓硝酸反应:
9、木炭和浓硝酸共热:
10、FeCl3溶液中加入KI溶液:
11、高锰酸钾固体中滴入浓盐酸:
12、氨水通入少量SO2:
13、偏铝酸钠溶液中加足量稀硫酸:
14、NaAlO2溶液中充入足量CO2:
15、Ba(AlO2)2溶液中加入硫酸铝溶液:
16、氢氧化亚铁水溶液在空气中变质:
12、氯化铁溶液溶解铜:
十、按要求写方程式
1、写出高温条件下发生的置换反应四个:
①
②
③
④
2、写出一个点燃条件下的置换反应:
3、写出一个加热条件下的置换反应:
4、写出一个有三种反应物的置换反应:
5、写出工业生产中需要高温条件的反应(不少于5个)的化学方程式:
6、试设计一个实验,检验某溶液中存在Fe2+,请在下面的横线上按操作顺序写出相应的离子方程式: 。
7、治疗胃酸过多的药物中常用Al(OH)3,如何用氧化铝制取氢氧化铝?要求制取过程中酸碱的用量降到最少。按生产顺序写出相关的离子方程式: 。
8、化学反应中有的具有相似性,有的反应具有特殊性,试写出下列相关化学方程式,并思考其中的原因:
① Li + O2
Na + O2
② Mg + CO2
Mg + SO2
③ Na2O2 + CO2
Na2O2 + SO2
KO2 + CO2
④ F2 + H2O
Cl2 + H2O
⑤ Fe + Cl2
Fe + I2
⑥ Fe(OH)3 + HCl
Fe(OH)3 + HI
9、按要求写化学方程式
①碱性氧化物与水反应(举2例)
②碱性氧化物与酸反应(举2例)
③金属氧化物但不是碱性氧化物的氧化物与水反应(举一例)
④酸性氧化物与水反应(举2例,其中一例为金属氧化物)
⑤能与水反应生成酸,但不是酸性氧化物也不是碱性氧化物氧化物与水反应的化学方程式:
。
⑥列举不少于5类既能与强酸反应,又能与强碱反应的物质,并分别写出它们与酸(HCl)、碱(NaOH)反应的离子方程式:
A、物质化学式:
B、物质化学式:
C、物质化学式:
D、物质化学式:
E、物质化学式:
F、物质化学式:
G、物质化学式:
10、某酸性氧化物,它能与某些酸反应,也能与碱反应,请写出这样的氧化物一种,并写出它与酸反应的化学方程式和与碱反应的离子方程式:
氧化物分子式:
查看答案和解析>>
科目: 来源: 题型:阅读理解
二、有机化学反应式:
5、![]()
6、CH2 =CH2 + Br2![]() CH2BrCH2Br
CH2BrCH2Br
7、CH2 =CH2 + H2O ![]() CH3CH2OH
CH3CH2OH
8、
![]()
9、![]()
11、CH ≡ CH + Br2![]() CHBr=CHBr
CHBr=CHBr
CHBr = CHBr+ Br2![]() CHBr2CHBr2
CHBr2CHBr2
12、
![]()

14、
![]()
15、
![]()
16、
![]()
17、

18、![]()
19、

20、2CH3CH2OH+2Na![]() 2CH3CH2ONa+ H2↑ü
2CH3CH2ONa+ H2↑ü
21、
![]()
23、![]()
25、![]()
26、

27、
28、
29、CH3CHO +2Ag(NH3)2OH ![]() H2O+2Ag↓?+3NH3+CH3COONH4
H2O+2Ag↓?+3NH3+CH3COONH4
30、乙醛与新制氢氧化铜悬浊液反应:Cu2+ +2OH- = Cu(OH)2↓?
![]()
31、2CH3COOH+Na2CO3![]() 2CH3COONa+CO2↑ +H2O
2CH3COONa+CO2↑ +H2O
32、
33、CH3COOCH2CH3+H2O![]() CH3COOH +CH3CH2OH
CH3COOH +CH3CH2OH
35、![]()
一、有机物的官能团:
3、卤(氟、氯、溴、碘)原子:-X 4、(醇、酚)羟基:-OH
5、醛基:-CHO 6、羧基:-COOH
二、有机反应类型:
取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
加成聚合(加聚)反应:不饱和的单体聚合成高分子的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。 氧化反应:有机物得氧或去氢的反应。 还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)
同分异构体:几种化合物具有相同的分子式,但具有不同的结构式。 1、碳架异构2、官能团位置异构3、官能团种类异构(即物质种类改变了):醇/酚、羧酸/酯、烯醇/醛 三、有机物燃烧通式烃:CxHy+(x+![]() )O2 → xCO2+
)O2 → xCO2+![]() H2O 烃的含氧衍生物: CxHyOz+(x+
H2O 烃的含氧衍生物: CxHyOz+(x+![]() -
-![]() )O2 → xCO2+
)O2 → xCO2+![]() H2O
H2O
四、有机合成路线:

补充:
1、
、各类有机物的通式、及主要化学性质 烷烃CnH2n+2 仅含C—C键 与卤素等发生取代反应、热分解 烯烃CnH2n 含C==C键 与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应 炔烃CnH2n-2 含C≡C键 与卤素等发生加成反应、与高锰酸钾发生氧化反应、聚合反应 苯(芳香烃)CnH2n-6 与卤素等发生取代反应、与氢气等发生加成反应 (甲苯、乙苯等苯的同系物可以与高锰酸钾发生氧化反应) 卤代烃:CnH2n+1X 醇:CnH2n+1OH或CnH2n+2O 苯酚:遇到FeCl3溶液显紫色 醛:CnH2nO 羧酸:CnH2nO2 酯:CnH2nO2 蛋白质:浓的无机盐(NH4)2SO4.Na2SO4使其盐析;加热.紫外线.X射线.强酸.强碱.重金属(Pb2+.Cu2+.Hg2+)及
有机物(甲醛.酒精.苯甲酸)使蛋白质变性;浓硝酸使蛋白质颜色变黄;蛋白质灼烧时,会有焦味.
五、有机物燃烧通式烃:CxHy+(x+![]() )O2 → xCO2+
)O2 → xCO2+![]() H2O 烃的含氧衍生物: CxHyOz+(x+
H2O 烃的含氧衍生物: CxHyOz+(x+![]() -
-![]() )O2 → xCO2+
)O2 → xCO2+![]() H2O
H2O
六、有机合成路线:

补充:
1、

2、

3、

4、
![]()
5、

6、

7、

8、
![]()
9、
 10、
10、

11、

12、

13、
![]()
14、
![]()
15、

16、
![]()
查看答案和解析>>
科目: 来源: 题型:阅读理解
无机化学反应式
1、2Na+2H2O=2NaOH+H2↑ ★ 2K+2H2O=2KOH+H2↑
2、2Na2O2+2H2O=4NaOH+O2↑ 3、2Na2O2+2CO2=2Na2CO3+O2
4、氢氧化钠和碳酸氢钠在溶液中反应的离子方程式为:
OH- +HCO3- =CO32- +H2O
氯气溶于水(新制氯水中含Cl2.HClO.H2O .H+ .Cl - .ClO - .OH-):
5、Cl2+H2O=HCl+HClO ★ Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):
6、2HClO![]() 2HCl+O2↑
2HCl+O2↑
7、Ca(ClO)2+CO2+H2O=CaCO3+2HClO
8、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
9、2F2+2H2O=4HF+O2 Cl2+H2O=HCl+HClO Br2+H2O=HBr+HBrO
10、2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al2O3+2NaOH=2NaAlO2+H2O
Al(OH)3+NaOH=NaAlO2+2H2O
11、H2O2的分解: 2H2O2![]() 2H2O+O2↑ *H2S与SO2的反应: 2H2S+SO2=3S+2H2O
2H2O+O2↑ *H2S与SO2的反应: 2H2S+SO2=3S+2H2O
12、2SO2+O2![]() 2SO3
2SO3
13、Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
14、C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
15、SiO2+2C![]() Si+2CO↑
Si+2CO↑
16、![]()
17、N2+O2 ![]() 2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
18、4NH3 +5O2 4NO+6H2O
4NO+6H2O
19、用浓盐酸检验氨气(白烟生成): NH3+HCl=NH4Cl
20、(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O
21、NH4NO3+NaOH=NaNO3+NH3↑+H2O
22、4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
23、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
24、FeCl3+3KSCN![]() 3KCl+Fe(SCN)3
3KCl+Fe(SCN)3
25、盐类水解: CH3COO- +H2O![]() CH3COOH+OH- CO32- +H2O
CH3COOH+OH- CO32- +H2O![]() HCO3-+OH-
HCO3-+OH-
HCO3- +H2O![]() H2CO3+OH- NH4+ +H2O
H2CO3+OH- NH4+ +H2O![]() NH3?H2O+H+
NH3?H2O+H+
Fe3+ +3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
27、铝热反应: 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
4Al+3MnO2![]() 3Mn+2Al2O3
3Mn+2Al2O3
28、2Mg+CO2![]() C+2MgO
C+2MgO
29、Al2(SO4)3+6NH3·¤H2O=2Al(OH)3↓?+2(NH4)2SO4
30、NaAlO2+HCl+H2O=Al(OH)3↓? +NaCl ; NaAlO2+CO2+H2O=Al(OH)3↓? +NaHCO3
31、高温下铁与水反应 :3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
32、FeCl3+3NaOH=Fe(OH)3↓?+3NaCl
33、4Fe(OH)2+O2+2H2O=4Fe(OH)3
34、2FeCl2+Cl2=2FeCl3 2FeCl3+Fe=3FeCl2
35、氯化铁溶液中加入铜粉: 2FeCl3+Cu=2FeCl2+CuCl2
36、金属的冶炼:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
CuO+C![]() Cu+CO↑
Cu+CO↑
![]()
37、铜锌原电池:正极:2H++2e- =H2↑
负极:Zn-2e- =Zn2+
38、钢铁的吸氧腐蚀:正极:O2+4e- +2H2O=4OH-
负极:Fe-2e- =Fe2+
39、Fe(OH)3胶体的制取:FeCl3 +3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
40、电解CuCl2溶液:阳极:2Cl- -2e- =Cl2↑
阴极:Cu2++2e- =Cu
总反应:CuCl2![]() Cu+Cl2↑
Cu+Cl2↑
41、铜的电解精炼:阳极:Cu-2e- =Cu2+
阴极:Cu2++2e- =Cu
42、电镀铜:阳极:Cu-2e- =Cu2+
阴极:Cu2++2e- =Cu
43、电解饱和食盐水:阳极:2Cl- +2e-=Cl2↑
阴极:2H+ +2e- =H2↑
总反应:2NaOH+2H2O![]() H2↑+2NaOH+Cl2↑
H2↑+2NaOH+Cl2↑
44、黄铁矿的燃烧: 4FeS2 +11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
45、氨水吸收少量SO2: SO2+2NH3 +H2O=(NH4)2SO3
46、C+H2O(g)![]() CO+H2
CO+H2
查看答案和解析>>
科目: 来源: 题型:
白色粉末A由Na2S、Na2SO3、Na2S2O3、Na2SO4、NaCl等物质中的三种混合而成。取一定量A样品投入100mL 2.2mol·L-1盐酸中,充分反应后过滤,最终得到100mL H+浓度为1mol·L-1的溶液。若将此溶液蒸干,只得到8.19g纯净物B。已知反应2H2S+SO2=3S+2H2O在常温下即可发生。
(1)B的化学式为 。
(2)A中是否含有NaCl? (填有或没有)
(3)若反应中还生成VL(已折算成标准状况下,且该气体不会使品红溶液褪色),则取出的A样品中含有Na2S mol(用含V的代数式表示)。
(4)A中各组成的物质的量比不同时,所产生的沉淀物的量亦不同。上述A样品与盐酸反应可生成的况淀物的质量最大值为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com