
科目: 来源: 题型:
常温下,0.1mol/L Na2CO3溶液中各微粒浓度关系正确的是
A.c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3)
B.c(Na+)>c(CO32-)>c(H+)>c(OH—)
C.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D. c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是
A.该电池Zn为负极,ZnO为正极,MnO2为催化剂
B.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时水分子和OH-都能通过薄层纸片
查看答案和解析>>
科目: 来源: 题型:
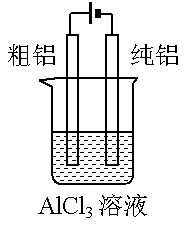
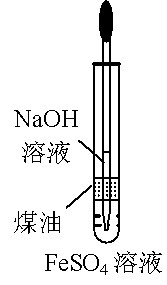
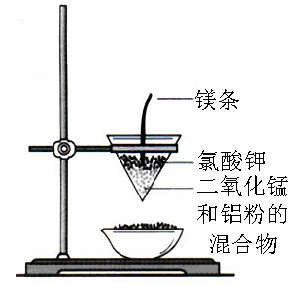
用下列装置能达到有关实验目的的是

甲 乙 丙 丁
A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
C.用丙图装置可制得金属锰 D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.金属钠投入CuSO4溶液中:2Na+Cu2+=2Na++Cu
B.硫酸铝溶液中加入足量氨水:Al3++4OH-=AlO2-+2H2O
C.FeSO4溶液与稀硝酸反应: 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
D.硫酸溶液中滴加足量氢氧化钡溶液:H++SO42-+Ba2++OH-=H2O+BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温下,2.24LN2和O2的混合气体所含原子数为0.2NA
B.常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA
C.标准状况下,30g NO和16g O2混合所生成的气体分子数为NA
D.标准状况下,6.72L CO2中所含的共用电子对数为1.2NA
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
A.原子半径:C>A
B.离子半径:D>B
C.非金属性:A>B
D.最高价氧化物对应水化物的碱性:C>D
查看答案和解析>>
科目: 来源: 题型:
FeCl3可用作印刷电路铜板腐蚀剂。为回收废腐蚀液中的铜,必须对废腐蚀液的组成进行分析。某同学取废腐蚀液200mL,分成甲、乙两等份。向甲溶液中滴加AgNO3溶液至不再有沉淀产生,得到沉淀129.15g;向乙溶液中加入10g足量铁粉,充分反应,剩余固体质量4.8g。计算中忽略溶液体积的变化。
⑴写出FeCl3溶液腐蚀印刷电路铜板的离子方程式,并标出电子转移的方向和数目 ▲ 。
⑵废腐蚀液中含有的Cl—离子的物质的量浓度是 ▲ 。
⑶计算废腐蚀液中铜离子的物质的量浓度(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
.某课外活动小组用铜屑制取五水合硫酸铜晶体。已知硫酸铜和硝酸铜的溶解度数据如下表:
T/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
硫酸铜/g | 14.8 | 20.5 | 28.5 | 39.6 | 53.6 | 73.0 |
硝酸铜/g | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
⑴课外活动小组设计的实验步骤如下:
①用灼烧法除去铜屑表面的有机物和油污。灼烧时需要使用到的仪器有 ▲ 。
A.烧杯 B.酒精灯 C.泥三角 D.蒸发皿 E.坩埚 F.漏斗
②将灼烧后的固体置于烧杯中,向其中加入一定量的硫酸,将烧杯放置在通风橱中加热,并向其中分批加入适量浓硝酸,直至反应结束,滤去少量不溶物。发生反应的化学方程式为: ▲ 。
③将所得滤液用水浴加热蒸发浓缩,待看到 ▲ 时,停止加热,冷却过滤得硫酸铜晶体。本操作采用水浴加热的原因 ▲ 。
④除去硫酸铜晶体中含有的少量硝酸铜。可以用 ▲ 法提纯硫酸铜晶体。
⑵该活动小组设计的制备硫酸铜晶体的实验方案,主要存在问题是消耗的酸多、产生的气体污染空气。请你重新设计一种经济、环保的实验方案: ▲ 。
查看答案和解析>>
科目: 来源: 题型:
铜及其合金是人类最早使用的金属材料。
⑴铜原子的核外电子排布式是 ▲ 。
⑵铜的熔点比钙高,其原因是 ▲ ;右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 ▲ 。
⑶Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 ▲ (填序号)。
A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 ▲ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com