
科目: 来源: 题型:
我国规定饮用水质量标准必须符合下列要求:
| PH值 | 6.5-8.5 |
| Ca2+,Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |
以下是源水处理成自来水的工艺流程示意图

(1) 源水中含Ca2+、Mg2+、![]() 、CL-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_____________
、CL-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_____________
(2) 凝聚剂除去悬浮固体颗粒的过程__________(填写编号,多选倒扣)
①只有物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4?7H2O常用的凝聚剂,它在水中最终生成___________沉淀。
(3) 通入二氧化碳的目的是_________________和_____________。
(4) 气体A的作用是________。这种作用是基于气体A和水反应的产物具有___________性。
(5) 下列物质中,______________可以作为气体A的代用品。(填写编号,多选倒扣)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
查看答案和解析>>
科目: 来源: 题型:
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用右图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。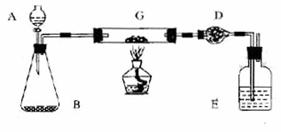
(1)实验目的:__________________________________。
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(3)实验内容:
| 实验过程 | 实验现象 | 有关化学方程式 |
| 在C中加入样品标本W克,D中装入精品后并称量为m克。连接好仪器后,检查气密性 | ||
| 打开A的活塞,慢慢洋加溶液。 | ||
| 对G进行加热。当G中药品充分反应后。关闭A的活塞。停止加热: | ||
| 冷却后,称量D的质量为m2克。 |
(4)计算:样品中铜的质量分类=___________________(用含W、m1、m2的代数式表示)
(5)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的钢的质量分数偏小的原因可能是_______________-,在B与G之间加入的装置可以是____________________,其中盛放的药品是__________________。
查看答案和解析>>
科目: 来源: 题型:
有效地利用现有能源和开发新能源已受到各国的普遍重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能。例如,加入CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在原子间连接形式有______(写编号,多选倒扣)。
![]()
(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一开然气常和石油伴生,其主要的成分是_________。能说明它是正四面体而非正方形平面结构的理由是_________(填写编号,多选倒扣)
① 其一氧取代物不存在同分异物体
② 其二氧取代物不存在同分异物体
③ 它是非极性分子
④它的键长和键角都相等
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50公里/小时行驶了40公里。为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济的制氢方法是_______(填写编号,多选倒扣)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后还需要解决的问题是_________(写出其中一个)
查看答案和解析>>
科目: 来源: 题型:
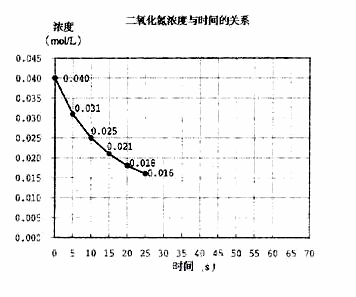
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。右图中的吗线表示二氧化氮分解反应在前25秒内的反应进程。
(1)请计算前20秒内氧气的平均生成速度:
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程吗线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式:____________
查看答案和解析>>
科目: 来源: 题型:
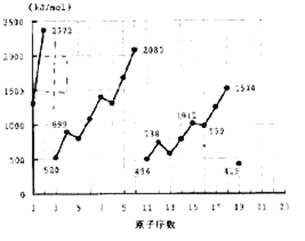
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:__________________________.
各主族中E值的这种变化特点体现了元素性质的__________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现试预测下列关系式中正确的是______(填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:___________<E<__________
(4)10号元素E值较大的原因是___________________
查看答案和解析>>
科目: 来源: 题型:
KclO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:![]()
(1)请完成该化学方程式并配平(未知物化学和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的是为_________mol.
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
查看答案和解析>>
科目: 来源: 题型:
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
A.9.02g B.8.51g C.8.26g D.7.04g
查看答案和解析>>
科目: 来源: 题型:
取pH值均等于2的盐酸和醒酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
查看答案和解析>>
科目: 来源: 题型:
氯只有![]() 和
和![]() 两各稳定同位素,它们在氯气中的原子数之比
两各稳定同位素,它们在氯气中的原子数之比![]() 为3:1。则分子量为70、72、74的氯气分子数之比可能是( )
为3:1。则分子量为70、72、74的氯气分子数之比可能是( )
A.5:2:1 B.5:2:2 C.9:3:1 D.9:3:2
查看答案和解析>>
科目: 来源: 题型:
下列变化规律中正确的是( )
A.H2S、HCl、PH3热稳定性由弱到强
B.物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH值由小到大
C.等质量的甲烷、乙稀、乙炔充分燃烧,所耗用氧气的量由多到少
D.CH3CH2OH、-OH、CH3COOH的酸性由弱到强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com