
科目: 来源: 题型:
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ?mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ?mol-1
C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ?mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ?mol-1
查看答案和解析>>
科目: 来源: 题型:
某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平行混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平行混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为( )
A.3.0mol B.1.5mol C.1.0mol D.0.75mol
查看答案和解析>>
科目: 来源: 题型:
将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
A.c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
B.c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+)
C.c(Ba2+)>c(NO3-)>c(OH-)>c(NH4+)
D.c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为( )
A.![]() He B.
He B.![]() He C.
He C.![]() He D.
He D.![]() He
He
查看答案和解析>>
科目: 来源: 题型:
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
(2)除去蒸馏水中溶解的O2常采用_____的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是________________________________________________________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
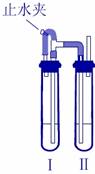
(1)在试管Ⅰ里加入的试剂是___________。
(2)在试管Ⅱ里加入的试剂是___________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______________________________________ ________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是_____;Y和X的组成元素相同,Y的化学式是_____;1 mol Z 在加热时跟水反应的产物需要用6 mol的氢氧化钠才能完全中和,Z的化学式是_____。其中和产物的化学式是_____。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是_____________。
查看答案和解析>>
科目: 来源: 题型:
A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:mA= mB+ mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:__________________________。
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式___________________________。
(3)A的正确选择有_____种,其化学式为:___________。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是__________________。mB:mC=1:___。(保留2位小数)
查看答案和解析>>
科目: 来源: 题型:
合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1m3(标准状况)CH4按上式完全反应,产生H2 mol。
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=31 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?
查看答案和解析>>
科目: 来源: 题型:
超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C![]() 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g?L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com