
科目: 来源: 题型:
美国“9?11”恐怖袭击事件给纽约带来了一场严重的环境灾难――石棉污染,易使吸入石棉者患肺癌,已知石棉是硅酸盐矿物,某种石棉的化学式可表示为:Ca2MgxSiyO22(OH)2,X、Y的值分别为( )
A.8, 3 B.5, 8 C.3, 8 D.5, 5
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是( )
A.NaOH溶液吸收过量的CO2: OH― + CO2 = HCO3―
B.NH4HSO3溶液与足量的NaOH溶液反应: HSO3―+ OH―= SO32―+ H2O
C.Ca(ClO)2溶液中通人二氧化硫: Ca2+ + 2 ClO-+ SO2 + H2O = CaSO3 + 2HClO
D.Na2CO3溶液使酚酞变红: CO32― + 2H2O ![]() 2OH― + H2CO3
2OH― + H2CO3
查看答案和解析>>
科目: 来源: 题型:
有A、B、C、D、E、F六瓶未知溶液.它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH.为了鉴别,各取少许溶液进行两两混和试验,结果如右表.表中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生成,"―"表示观察不到明显的现象变化。
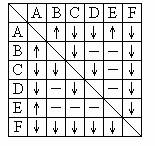
(1)请写出下列物质的化学式:
C___________、D___________、E___________、F___________.
(2)写出A、B反应的离子方程式:______________________________________。
查看答案和解析>>
科目: 来源: 题型:
归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
性质\元素 | 8O | 16S | 34Se | 52Te |
单质熔点(℃) | -218.4 | 113 | 450 | |
单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是_________
(2)碲的化合价可能有_________
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是_________ (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
A12Te3 + ( ) A1(OH)3↓ + H2Te↑
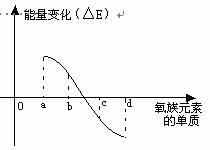
(6)右图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
查看答案和解析>>
科目: 来源: 题型:
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式:_____________________________________________
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式_____________________________________________。
②反应中生成的氧化产物与还原产物的物质的量之比是____________,
每分解1mol高氯酸铵,转移的电子数目是_________。
查看答案和解析>>
科目: 来源: 题型:
下列实验操作错误的是( )
A. 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
B. 玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上
C. 配制5%食盐溶液时,将称量的食盐放入烧杯中加计量的水搅拌溶解
查看答案和解析>>
科目: 来源: 题型:
某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是( )
A.Mg2+、Al3+、HCO3-、SO32-
B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3-
D.NH4+、Fe3+、SO42-、SCN-
查看答案和解析>>
科目: 来源: 题型:
某溶液中存在较多的K+、H+、I-,可以在上述溶液中大量共存的是( )
A.Cl-、NH4+、Na+ B.Na+、HCO3-、SO42-
C.Fe3+、Cl-、NO3- D.ClO-、Br-、NH4+
查看答案和解析>>
科目: 来源: 题型:
硫酸铜遇到黄铁矿(FeS2)可以发生反应: 14CuSO4 + 5FeS2 + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4 ,在该反应中,被氧化的硫原子与被还原的硫原子的物质的量之比为: ( )
A. 7:3 B. 3:7 C. 7:5 D. 5:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com