
科目: 来源: 题型:
莽草酸是合成治疗禽流感的药物――达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
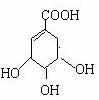
(1)A的分子式是___________________。
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是
(4)A在浓硫酸作用下加热可得到B(B的结构简式为HO-![]() -COOH),其反应类型是___________________.
-COOH),其反应类型是___________________.
(5)B的同分异构体中既含有酚羟基又含有酯基的共有________种,写出其中一种同分异构体的结构简式_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有:
①___________________________________________________;
②____________________________________________________。
用离子方程式表示产生上述现象的原因______________。
(2)在饱和氯化铁溶液中加入一种单质,也会发生类似上述现象的反应,这种单质是_______。
A、磷 B、硫 C、镁 D、铜
(3)向物质的量之和为0.1mol的FeCl3和AlCl3混合溶液中加入90 mL 4mol?L-1的NaOH溶液,使其充分反应。假设原溶液中Al3+物质的量与Al3+和Fe3+总物质的量之比为x。
①当x=0.4时,溶液中产生的沉淀是_______,其物质的量为_______________
②当沉淀只有Fe(OH)3时,x的取值范围是________________________。
查看答案和解析>>
科目: 来源: 题型:
化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→
H-I(g),△H= -297KJ/mol即H-I键的键能为297KJ?mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。
下表是一些键能数据(KJ?mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
回答下列问题:
(1)由表中数据能否得出这样的结论:
①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)
②非金属性越强的原子形成的共价键越牢固______(填“能”或“不能”)。能否从数据找出一些规律,请写出一条:______________________________________________;
试预测C-Br键的键能范围_____<C-Br键能<_____。
(2)由热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ?mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是_______________,由热化学方程式2H2(g)+S2(s) →2H2S(g);△H=-224.5KJ?mol-1和表中数值可计算出1mol S2(s)气化时将_______(填“吸收”或“放出”)_____KJ的热量。
(3)通过上表预测卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是__________________。
查看答案和解析>>
科目: 来源: 题型:
工业上用氮气和氢气合成氨,实际生产过程中常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请运用化学反应速率和化学平衡的观点说明采取该措施的理由: 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:居室中甲醛含量不得超过0.08mg/m3。可利用酸性高锰酸钾溶液测定甲醛。
测定原理:KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为:4MnO4 +5HCHO+H+ ==4Mn2+ +5CO2↑+11H2O
2MnO4 +5H2C2O4 +6H+ ==2Mn2+ +10CO2 ↑+8H2O
测定装置:部分装置如下图所示(a、b为止水夹)

测定步骤:
①收集待检新装修的房屋居室空气5L。
②准确量取5.00mL 1.00×10-3mol•L-1 的高锰酸钾溶液于250mL锥形瓶中,滴入3滴6mol•L-1 的H2SO4 溶液,加水45mL稀释备用。
③将1.00×10-3mol•L-1 的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00mL)。3次实验所消耗草酸溶液的体积平均值为12.38mL。
回答以下问题:
(1)使用 量取5.00mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?使结果偏高还是偏低?
。
(3)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。 。
(4)计算该居室内空气中甲醛的浓度 mg/m3,该居室的甲醛 (填是或否)超标。
查看答案和解析>>
科目: 来源: 题型:
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:____________.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是______,装置C中的烧瓶需要加热,其目的是:______。
②装置D中发生反应的化学方程式为_____________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及____________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________________
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目: 来源: 题型:
下列有关实验的说法正确的是_________。
A.配制100g10%的硫酸铜溶液时,称取10g硫酸铜晶体溶解于90g水中
B.鉴别溴乙烷:先加NaOH溶液,微热,在加稀HNO3酸化后,再加AgNO3溶液
C.制乙烯时,温度计应插入反应混合液中
D.用3mL乙醇、2mLH2SO4、2mL冰醋酸制乙酸乙酯,为增大反应速率,现改用6mL乙醇、4mLH2SO4、4mL冰醋酸
E.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热至沸腾,产生黑色沉淀,原因可能是NaOH量太少
查看答案和解析>>
科目: 来源: 题型:
某些高温油炸食品中含有一定量的CH2=CH―C―NH2(丙烯酰胺) ,2002年瑞典科学家发现,食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述正确的是:( )
A.能使酸性KMnO4溶液褪色
B.能发生加聚反应生成高分子化合物
C.有4种同分异构体;
D.能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式错误的是( )
A.硫化钠的第一步水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.铜跟浓硝酸反应Cu+2N03-+4H+=Cu2++2N02↑+2H2O
C.碳酸钙跟稀盐酸反应C032-+2H+=CO2↑+H2O
D.铁跟氯化铁溶液反应Fe+2Fe3+=3Fe2+
查看答案和解析>>
科目: 来源: 题型:
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com