
科目: 来源: 题型:
已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目: 来源: 题型:
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
A. C(s)+![]() O2(g)=CO(g);△H=-393.5 kJ/mol
O2(g)=CO(g);△H=-393.5 kJ/mol
B. 2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C. CH4g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D. ![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
温度相同、浓度均为0.2 mol的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤![]() ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
A. ③①④②⑥⑤ B. ①③⑥④②⑤
C. ③②①⑥④⑤ D. ⑤⑥②④①③
查看答案和解析>>
科目: 来源: 题型:
2gCu2S和 CuS的混合物在酸性溶液中用 400 mL
0.075 mol / LKMnO4 溶液处理,发生反应如下:
8MnO- 4 +5Cu2S + 44H + ==10Cu 2+ + 5SO2+8Mn 2+ +22H2O
6MnO- 4 +5CuS + 28H + ==5Cu 2+ + 5SO2+6Mn 2+ +14H2O
反应后煮沸溶液,赶尽 SO2,剩余的 KMnO4 恰好与 350mL 0.1 mol/ L (NH4)2Fe (SO4)2
溶液完全反应。
(1)配平 KMnO4 与(NH4)2Fe (SO4)2 反应的离子方程式
![]()
(2)KMnO4 溶液与混合物反应后,剩余 KMnO4 的物质的量为_________ mol.
(3)欲配制 500mL0.1 mol / Fe 2+ 溶液,需称取(NH4)2Fe (SO4)2?6H2O (M=392g/mol)
的质量为 __________g。
(4)混合物中 Cu2S的质量分数为 __________。
查看答案和解析>>
科目: 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤
如下:
① 高温下用碳还原二氧化硅制得粗硅 300℃
②粗硅与干燥 HCl气体反应制得 SiHCl3:Si +3HCl =====SiHCl3+H2
③SiHCl3 与过量 H2 在 1000~1100℃反应制得纯硅
已知 SiHCl3,能与 H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 __________________。
(2)粗硅与HCl反映完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点
57.6℃)和 HCl(沸点-84.7℃),提纯 SiHCl3 采用的方法为。
(3)用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略去):
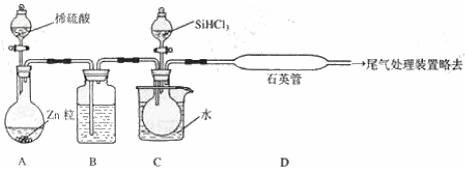
①装置 B中的试剂是 ______________。
装置 C中的烧瓶需要加热,其目的是 _____________________。
②反应一段时间后,装置 D中观察到的现象是 _________________,装置 D不能采用普通玻璃管的原因是__________________ ,装置D中发生反应的化学方程式为_______________ 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以
及____________________ 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________ 。
a. 碘水 b.氯水 c.NaOH溶液
b. d.KSCN溶液 e.Na2SO3 溶液
查看答案和解析>>
科目: 来源: 题型:
碱存在下,卤代烃与醇反应生成醚(R-O-R‘):
KOH
R-X + R‘OH ---→ R-O-R ’ +HX
室温
化合物 A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下:
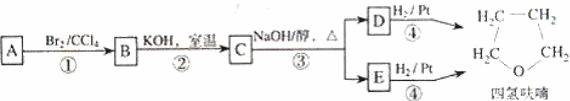
请回答下列问题:
(1)1molA和 1molH2 在一定条件下恰好反应,生成饱和一元醇 Y,Y中碳元素的质量
分数约为 65%,则 Y的分子式为 _____________________。
A分子中所含官能团的名称是 _________________。
A的结构简式为 _________________。
(2)第①②步反应类型分别为① ______________② ________________。
(3)化合物 B具有的化学性质(填写字母代号)是 __________________。
a. 可发生氧化反应 b.强酸或强碱条件下均可发生消去反应
b. 可发生酯化反应 d.催化条件下可发生加聚反应
(4)写出 C、D和 E的结构简式:
C ______________、D和 E __________________。
(5)写出化合物 C与 NaOH水溶液反应的化学方程式:
__________________________________________________
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式:
________________________________.
查看答案和解析>>
科目: 来源: 题型:
中学化学中几种常见物质的转化关系如下:
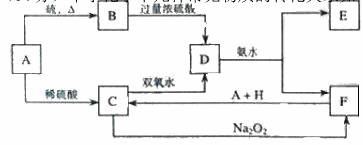
将 D溶液滴入沸水中可得到以 F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中 F粒子直径大小的范围:___________________。
(2)A、B、H的化学式:A __________、B ___________、H ___________。
(3)①H2O2 分子的电子式:________________ 。
②写出 C的酸性溶液与双氧水反应的离子方程式:____________________________。
(4)写出鉴定 E中阳离子的实验方法和现象:
(5)在 C溶液中加入与 C等物质的量的 Na2O2,恰好使 C转化为 F,写出该反应的离子方程式:
查看答案和解析>>
科目: 来源: 题型:
已知反应:①101Kpa时,2C(s)+O2(g)==2CO(g);△H= -221 kJ/mol
②稀溶液中,H +(aq)+OH -(aq)== H2O(1);△H= -57.3kJ/mol
下列结论正确的是 ( )
A.碳的燃烧热大于 110.5 kJ/mol
B.①的反应热为 221 kJ/mol
C.稀硫酸与稀 NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀 NaOH溶液反应生成 1mol水,放出 57.3kJ热量
查看答案和解析>>
科目: 来源: 题型:
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中 的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O == 4A1(OH)3, 下列说法不正确的是 ( )
A.正极反应式为:O2+2H2O+4e ==40H -
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
查看答案和解析>>
科目: 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:( )
![]()
下列叙述正确的是
A.加入少量 W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入 X,上述反应的△H增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com