
科目: 来源: 题型:
已知热化学反应方程式:Zn(s)+![]() O2(g)
O2(g)![]() ZnO(s);ΔH=-351.5 kJ?mol-1; Hg(l)+
ZnO(s);ΔH=-351.5 kJ?mol-1; Hg(l)+ ![]() O2(g)
O2(g)![]() HgO(s);ΔH=-90.84 kJ?mol-1,则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)
HgO(s);ΔH=-90.84 kJ?mol-1,则锌汞电池中热化学反应方程式:Zn(s)+HgO(s) ![]() ZnO(s)+Hg(l)的ΔH为( )
ZnO(s)+Hg(l)的ΔH为( )
A.、ΔH=+260.7 kJ?mol-1 B、.ΔH=-260.7 kJ?mol-1
C、.ΔH=-444.2 kJ?mol-1 D.、ΔH=+444.2 kJ?mol-1
查看答案和解析>>
科目: 来源: 题型:
根据下表下列叙述中正确的是:
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较: KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较: H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下22.4L PCl3中含有的原子数为4NA
B.标准状况下22.4L NO2中含有的原子数为3NA
C.1mol FeCl3若完全水解可以形成NA个![]() 胶粒
胶粒
D.2.90g 熟石膏(2CaSO4?H2O)晶体中结晶水的数目0.01NA个
查看答案和解析>>
科目: 来源: 题型:
下列各组离子,在指定的条件下能大量共存的是( )
A、水电离出来的c (OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
B、在c(H+)=10-14mol/L的溶液中可能含:Na+,A1O2―,CO32―,SO32―
C.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
D. 某溶液,加铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
查看答案和解析>>
科目: 来源: 题型:
下列有关叙述正确的是( )
A. 亚硝酸盐作为工业用盐,在食品中作防腐剂和增色剂,用量无严格限制
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
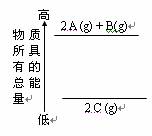
C. 右图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为: 2 A(g)+ B(g) = 2 C(g);△H=Q kJ?mol-1(Q<0 )
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的导电性强
查看答案和解析>>
科目: 来源: 题型:
利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示
的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
⑴写出电解池A、电解池B和光催化反应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol?L-1和b mol?L-1,光催化反应生成Fe3+的速率为c mol?L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
查看答案和解析>>
科目: 来源: 题型:
香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2。该芳香内酯A经下列步骤转变为水杨酸和乙二酸。
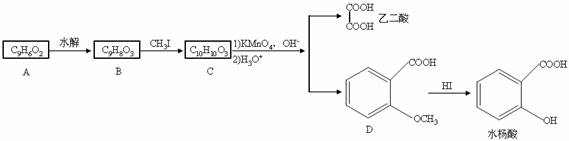
提示:
①CH3CH===CHCH2CH3①KMnO4、OH-_![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
②R-CH=CH2HBr_![]() R-CH2-CH2-Br
R-CH2-CH2-Br
请回答下列问题:
⑴写出化合物C的结构简式_______________。
⑵化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有_______________种。
⑶在上述转化过程中,反应步骤B→C的目的是_______________。
⑷请设计合理方案从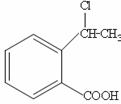 合成
合成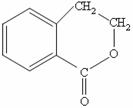 (用反应流程图表示,并注明反应条件)。
(用反应流程图表示,并注明反应条件)。
例:由乙醇合成聚乙烯的反应流程图可表示为
![]()
查看答案和解析>>
科目: 来源: 题型:
下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
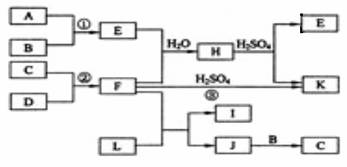
请按要求填空:
⑴反应③的化学方程式______________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH控制较难操作,可改用____________________。
查看答案和解析>>
科目: 来源: 题型:
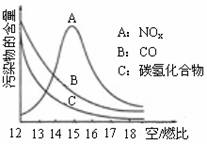
(10分)稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如右图所示。
⑴稀薄燃烧技术除能节约能源外,还具有的优点是_______________(填一项)。排放到大气中的NOx会导致酸雨、_______________等环境问题(填一项)。
⑵某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是______________。
⑶若某一催化剂能同时催化NH3等还原性气体与的反应NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗的物质的量较多的可能是_______________(填字母),原因是______________________________。
A.① B.② C.都有可能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com