
科目: 来源: 题型:
短周期的六种元素A、B、C、X、Y、Z,原子序数依次变小,其中X、Y、Z原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成10电子化合物Q;C与X处于同周期,B+与C2-的核外电子排布相同,A与B处于同周期,且形成BA型化合物。请回答:
(1)化合物Q的空间构型为_______________;化合物YC2电子式是________________;
(2)A、B、C的离子半径由大到小的顺序为____________________(用元素离子符号表示);
(3)元素组成为XZ5YC3和BCZ(足量)化合物反应的离子方程式为____________________;
(4)工业上,若输送元素A的单质的管道漏气,用Q进行检验时可观察到大量白烟,同时有X的单质生成,写出有关反应的化学方程式_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
有氧化铜和三氧化二铁的混合物ag,加入2mol/L的HCl溶液50mL,恰好完全溶解,若将2ag该混合物在CO气流中加热并充分反应,冷却后,剩余固体的质量为( )
A.(2a-1.6)g B.(2a-3.2)g C.1.6ag D.0.8ag
查看答案和解析>>
科目: 来源: 题型:
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图,符合图中情况的一组物质是( )

| A | B | C | D | |
| X | Ba(HCO3)2 溶液 | Na2CO3 溶液 | KOH 溶液 | CO2 气体 |
| Y | NaOH 溶液 | CaCl2 溶液 | Mg(HSO4)2 溶液 | 石灰水 |
查看答案和解析>>
科目: 来源: 题型:
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到2molFe(OH)3沉淀,此间共消耗水的物质的量为( )
A.2mol B.3mol C.4mol D.5mol
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中有如下反应:aX(g)+bY(g) ![]() nW(g);ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
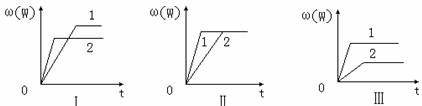
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
查看答案和解析>>
科目: 来源: 题型:
将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到溶液中离子浓度关系不正确的是( )
A.c(K+)>c(Na+)> c(H+)>c(OH-)
B.c(Na+)+ c(K+)+ c(H+) = 2c(SO42-)+ c(HS-)+ c(OH-)+2c(S2-)
C.c(SO42-)> c(HS-)> c(OH-)> c(H+)
D.c(K+) = c(S2-)+ c(H2S)+c(HS-)+c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
一定温度下,取0.2 mol/L HX溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化,下同)得溶液甲;另取0.2 mol/L HX溶液与0.1 mol/L NaOH溶液等体积混合得溶液乙。测得溶液甲的pH=8,溶液乙的pH>7。下列结论错误的是( )
A.甲溶液中由水电离出的c(OH¯) > 0.2 mol/L HX溶液中由水电离出的c(H+)
B.甲溶液中c(Na+) ― c(X-)=1.0×10−8 mol/L
C.甲溶液中c(OH-) ― c(HX) =1.0×10−8 mol/L
D.相同条件下,HX的电离程度 > NaX的水解程度
查看答案和解析>>
科目: 来源: 题型:
今有甲、乙、丙三瓶等体积等浓度的新制氯水,浓度均为0.1mol?l-1。如果甲瓶中加入少量的NaHCO3晶体m mol,在乙瓶中加入少量的NaHSO3晶体m mol,丙瓶不变,片刻后,甲、乙、丙三瓶中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>甲>丙
查看答案和解析>>
科目: 来源: 题型:
对于平衡体系:mA(g)+nB(g) ![]() pC(g)+qD(g),下列判断正确的是( )
pC(g)+qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度,达到新平衡时A的浓度变为原来的0.55倍,说明该反应△H<0
D.若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原体积要小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com