
科目: 来源: 题型:
物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。下列有关说法正确的是( )
A.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>HY>HX
B.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ
C.X-、Y-、Z-三种酸根均能水解,且水解程度Z->Y->X-
D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(Z-)>c(Y-)>c(X-)
查看答案和解析>>
科目: 来源: 题型:
下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl B.2KClO3=2KCl+3O2↑
C.2Na2O2+2H2O=4NaOH+O2↑ D.Ba(OH)2?8H2O+2 NH4Cl=BaCl2+ NH3↑+10H2O
查看答案和解析>>
科目: 来源: 题型:
下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目: 来源: 题型:
下列变化为放热反应的是( )
A.能量变化如图所示的化学反应

B.H2O(g)=H2O(l);△H=-44.0 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.2HI(g)=H2(g)+I2(g);△H=+14.9 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L 的NaOH溶液(密度1.12.g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0600mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl―的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2): n(H2)= 。
查看答案和解析>>
科目: 来源: 题型:
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:
硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平、酒精灯
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2)指出实验步骤中存在的错误并改正: ;
(3)硫酸钠不能放置在空气中冷却的原因是: ;
(4)步骤⑤的目的是 ;
(5)下面的情况有可能造成测试结果偏高的是 (填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出
查看答案和解析>>
科目: 来源: 题型:
有一无色透明溶液,欲确定含有下列离子中的哪几种:
K+、Mg2+、Al3+、Ba2+、NO3―、SO42―、Cl―、I―、HCO3―。取该溶液实验如下:
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加足量BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是 ,溶液中肯定不存在的离子是 。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称:
查看答案和解析>>
科目: 来源: 题型:
有X、Y、Z三种常见元素,已知:
①X2―、Y―均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学方程式 ;
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式:
此液体具有的性质是 (填写序号字母)。
a. 光束通过该液体时形成光亮的“通路”
b. 插入电极通过直流电后,阴极附近液体颜色加深
c. 向该液体中加入硝酸银溶液,无沉淀产生
d. 将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体R。已知一定条件下,每1mol气体R被O2完全氧化生成气体L放热98.0KJ。
①写出R被氧化的热化学方程式:
②若2mol R与1mol O2在此条件下发生反应,达到平衡时放出的热量是188.2kJ,则R的转化率为 。(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意如图1所示。

图1
①X分子的空间结构为 ;
②图1中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
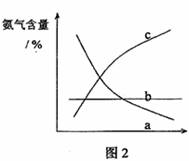
③改变反应条件,会使平衡发生移动。如图2表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
;
②常温时,氨水中由水电离出的c(H+)?c(OH―) 10―14(填写“>”、“<”或“=”);
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3mol A。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1mol B,转移电子的物质的量为 mol。
查看答案和解析>>
科目: 来源: 题型:
甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,细(虚)线不表示化学键或分子间作用力,X与Y可以相同也可以不同。已知甲、乙是同类晶体中的各自结构单元,单质甲能与乙发生置换反应,丙、丁、戊三种粒子含有等量的电子数,其中丙与丁晶体类型相同,常温下化合物丁呈液态,戊是阳离子。
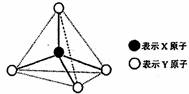
(1)丁的电子式是 ,丁固态时的晶体类型为 。
(2)常温下戊的硝酸盐溶液的pH 。
A.>7 B.=7 C.<7 D.以上都有可能
(3)甲与乙发生置换反应的化学方程式为 。
(4)丙分子的结构式是 ,它是目前重要的能源物质,现代高能电池中常用丙作燃料电池的原料,在碱性介质(KOH溶液)情况下,其负极反应的电极方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com