
科目: 来源: 题型:
下列说法正确的是:( )
A.常温下,将pH=3的盐酸与pH=b的氨水等体积混合,混合液pH=7,则b<11
B.pH=11的Na2CO3溶液加水稀释,溶液中所有的离子浓度均降低
C.常温下醋酸分子不可能存在于pH>7的碱性溶液中
D.0.1mol/L酸HA与0.1mol/L NaOH溶液等体积混合后pH>7,则混合物中
c(Na+)=c(A-)+c(HA)=0.1mol/L
查看答案和解析>>
科目: 来源: 题型:
下列说法中不正确的是:( )
A.蛋白质溶液中的蛋白质能透过半透膜
B.电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室
C.合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率
D.C(石墨,s) C(金刚石,s);△H>0,所以石墨比金刚石稳定
查看答案和解析>>
科目: 来源: 题型:
环境污染已成为人类社会面临的重大威胁,下列名词与环境污染有关的是:( )
①酸雨 ②臭氧空洞 ③“白色污染” ④温室效应 ⑤赤潮 ⑥光化学污染 ⑦噪声
A.①③④⑤ B.①②③④⑥⑦ C.③④⑤⑥⑦ D.①②③④⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为
CH3OH+Cr2O72-+8H+ = CO2↑+2Cr3+6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
Cr2O72-+ Fe2++ H+―― Cr3++ Fe3++ H2O
现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2mol?L-1K2Cr2O7溶液反应,多余的K2Cr2O7 再用1mol?L-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步中离子方程式。
(2)计算工业甲醇的质量分数。
查看答案和解析>>
科目: 来源: 题型:
实验室为监测空气中汞蒸气的含量,往往悬挂涂有Cul的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg == Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
□Cu2+ + I-→□CuI+□I-;
查看答案和解析>>
科目: 来源: 题型:
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、
SO42-、Cl-、I-、HCO3-,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加入几滴甲基橙 | 溶液变红色 |
| ②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,后在空气中又变成红棕色 |
| ③取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ⑤取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是 。
(2)溶液中肯定不存在的离子是 。
(3)为进一步确定其他离子,应该补充的实验是 。
查看答案和解析>>
科目: 来源: 题型:
中学化学中几种常见物质的转化关系如下:(提示:A与硫反应生成低价态)
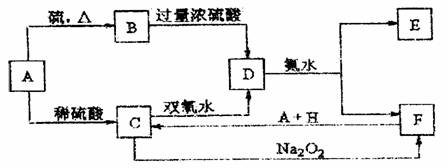
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)B、H的化学式:B ,H 。
(3)H2O2分子的电子式:
(4)写出鉴定E中阳离子的实验方法和现象: 。
查看答案和解析>>
科目: 来源: 题型:
用6mol?L-1的硫酸配制100mL1.0mol?L-1硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.20mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号) 。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号) 。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)怎样检查容量是否漏水 。
查看答案和解析>>
科目: 来源: 题型:
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化碳,其变化可表述为:aKClO3+bHCl(浓)――cKCl+dClO2+eCl2↑+fH2O
(1)浓盐酸在反应是显示出来的性质为 、 ;
还原产物为(填名称) 。
(2)根据Cl元素守恒得a、b、c、…的关系式为 。
(3)产生2molClO2,则转移的电子的物质的量为 mol。
(4)写出该反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是( )
A.1 B.2 C.3 D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com