
科目: 来源: 题型:
下列各组物质的溶液混合,如果其中的酸过量,仍有沉淀生成的是( )
A.Cu(NO3)2、NaOH、HCl B.NaOH、FeCl3、H2SO4
C.Ba(OH)2、CuSO4、HCl D.K2CO3、NaCl、HNO3
查看答案和解析>>
科目: 来源: 题型:
把下列四种X溶液分别加入四个盛有10mL2mol/L的盐酸的烧杯中,均加水稀释到50mL,此时X与盐酸反应时,其中反应速率最大的是( )
A.20mL 3mol/L的X溶液 B.20mL 2mol/L的X溶液
C.10mL 4mol/L的X溶液 D.10mL 2mol/L的X溶液
查看答案和解析>>
科目: 来源: 题型:
下列有关纯铁的描述正确的是( )
A.熔点比生铁的低
B.与相同浓度的盐到反应生成氢气的速率比生铁的快
C.在冷的浓硫酸中不发生任何化学变化
D.在空气中不容易被腐蚀
查看答案和解析>>
科目: 来源: 题型:
将Na2O2与NaHCO3的均匀混合物粉末分成等质量的两份,其中一份加入100mL盐酸使其充分反应,溶液呈中性,放出气体2.24L(标准状况);将生成的气体通入另一份混合物中充分反应后,气体体积变为2.016L(标准状况)。求:
(1)混合物中Na2O2和NaHCO3的物质的量之比
(2)加入盐酸的物质的量浓度。
查看答案和解析>>
科目: 来源: 题型:
为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,某探究活动小组分别设计了如下实验方案:
(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施 ;
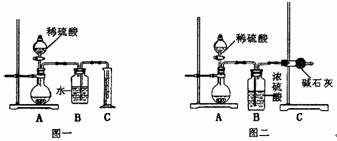
(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①
②
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品m g,放入锥形瓶中加蒸馏水溶解,加1―2滴酚酞指示剂,用物质的量浓度为c mol?L―1的HCl溶液滴定至溶液由红色至无色(指示CO32―+H+=HCO3―反应的终点),消耗HCl溶液体积为V1mL,再加入1―2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++HCO3―=CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2ml。则烧碱样品中Na2CO3的质量分数为 ;
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤
②用测得的数据(用字母表示)写出质量分数的表达式 。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E均为可溶于水的固体,组成它们的离子有
| 阳离子 | NH4+、Ag+、Mg2+、Ba2+、Al3+ |
| 阴离子 | Cl―、OH―、NO3―、CO32― |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B、C、D溶液反应最终均生成白色沉淀;
②C溶液与D溶液反应生成白色沉淀,同时放出无色气体;
③D溶液与适量E反应生成白色沉淀,加入过量E溶液,白色沉淀消失。
(1)据此推断它们是(填化学式)
A ;B ;C ;D ;E ;
(2)写出下列反应的离子方程:
①C溶液与E溶液在加热条件下反应 ;
②过量E溶液与D溶液反应 ;
查看答案和解析>>
科目: 来源: 题型:
下图表示的反应关系中,部分产物被略去,已知2mol白色固体粉末X受热分解,恢复到室温生成A(白色固体)、B、C各1mol,X、E、G的焰色反应均为黄色。
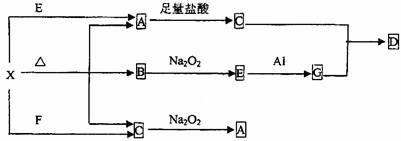
回答下列问题:
(1)写出下列物质的化学式:X ,G ,D ;
(2)写出G与C反应生成D的离子方程式 ;
(3)写出X+E→A的离子方程式 ;
(4)写出C与Na2O2反应的化学方程式 ;
若有0.2mol Na2O2参加反应,则转移的电子数为 。
查看答案和解析>>
科目: 来源: 题型:
氧化还原反应中实验上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3―+4H++3e―→NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原反应过程发生。
(1)写出并配平该氧化还原反应的离子方程式:
(2)反应中硝酸体现了 和 性质。
(3)反应中若产生0.5mol气体,则转移电子的物质的量是 mol
(4)若1mol甲与某浓度硝酸反应时,和(1)反应相比被还原硝酸的物质的量增加,原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com