
科目: 来源: 题型:
铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
请回答下列问题:
(1)向原混合物中,逐滴加入过量硝酸,充分反应,下列说法正确的是 。
a. 铁粉先反应,生成Fe2+
b. 铁粉全部溶解后,铜粉才反应
c. 最后溶液中含Fe3+和Cu2+
(2)在实验中,所用硝酸的浓度为 。
(3)在实验①中,溶解了Fe的质量是否为5.6g: ;实验②中溶解了Cu是否为9.6g: (填“是”或“否”)。
(4)在实验④中,V的值为: 。
查看答案和解析>>
科目: 来源: 题型:
有50mL NaOH溶液,向其中逐渐通入一定量的CO2,取此溶液10mL将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L―1的HCl溶液,产生CO2气体的体积(标准状况)与所加入盐酸体积之间的关系如图所示:
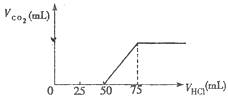
回答下列问题:
(1)稀释后的溶液中含有的溶质为 。
(2)标准状况下生成CO2的体积为 。
(3)原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝中含碳或氧化铝杂质,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应
ALN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实际现象来确定杂质的成分(实验中导管体积忽略不计)。
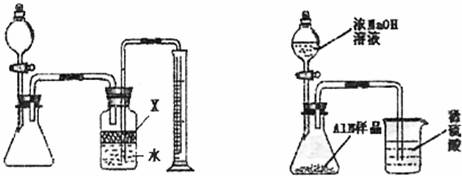
(1)实验有关操作为:a、往锥形瓶中放入适量的AlN样品;b、从分液漏斗往锥形瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积。
正确的操作顺序为 。
(2)本实验中检验装置气密性的方法是 。
(3)广口瓶中的试剂X可选用的是 (填选项的标号)。
A.汽油 B.酒精 C.植物油 D.CCl4
(4)若广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将 (填“偏大”“偏小”或“不变”)。
(5)实验结束后,若观察到锥形瓶中还有固体,则样品含有的杂质是 。
(6)已知样品的质量为Wg,若实验结束后测得氨气的体积为aL(标况下),则样品中AlN的质量分数为 (AlN的式量为41)。
(7)有人改用图II装置进行同样的实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为是否可行? (填入“可行”、“不可行”)。原因是
。
查看答案和解析>>
科目: 来源: 题型:
下图中所示的实验方法、装置或操作有明显错误,指出错误所在,不必作图。

(1)制取氨气:错在 。
(2)称量硝酸钾固体:错在 ,这种称量方法,实际所得硝酸钾的质量是 。
(3)干燥SO2体:错在 。
(4)将溶液稀释至250mL定容时,观察点如图所示,错在 ,此时所配制的溶液浓度偏 (填“大”或“小”)。
查看答案和解析>>
科目: 来源: 题型:
根据下列框图填写下列空格:

(1)写出下列物质的化学式:A ,C ,D ,F 。
(2)写出下列反应的离子方程式:
B与浓盐酸: 。
H与NaOH溶液: 。
(3)在常温下,单质C与浓硫酸共存的现象为: 。
查看答案和解析>>
科目: 来源: 题型:
与纯水的电离相似,在液氨中也存在关微弱的电离:2NH3![]() NH4++NH2―
NH4++NH2―
(1)据此判断以下叙述中错误的是 。
A.液氨中含有NH3、NH+4、NH―2等微粒
B.一定温度下液氨中C(NH+4)?C(NH―2)是一个常数
C.液氨的电离达到平衡时C(NH3) =C(NH+4)=C(NH―2)
D.只要不加入其他物质,液氨中C(NH+4)=C(NH―2)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体 。
②列举在液氨中,与“H++OH―=H2O”的实质相类似的化学方程式
。
(3)NaNH2加入水中,是否有化学反应发生 ,写出可能的化学反应方程式
。
查看答案和解析>>
科目: 来源: 题型:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为
Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)

根据题意完成下列各题:
(1)反应达到平衡时,如果升高温度,CH3OH的体积分数 (填“增大”、“减少”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因可能是: (用化学方程表示)。
查看答案和解析>>
科目: 来源: 题型:
铁酸钠(Na2 FeO4)可作为一种新型净水剂,在反应中Na2 FeO4被还原为Fe3+离子,请简述铁酸钠之所以能净化水,除了具有强氧化性,能消毒杀菌外,另一原因是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com