
科目: 来源: 题型:
下表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
|
| |||
| A | B | C |
|
|
|
| D |
|
|
|
①原子半径大小比较为D>A>B>C ②生成的氢化物分子间均可形成氢键
③A与C形成的阴离子可能有AC32-、A2C42- ④A、B、C、D的单质常温下均不导电
A.① B. ①③ C.②④ D.③④
查看答案和解析>>
科目: 来源: 题型:
下列叙述合理的是( )
A.金属材料都是导体,非金属材料都是绝缘体
B.棉、麻、丝、毛及合成纤维完全燃烧都是只生成CO2和H2O
C.水电站把机械能转化成电能,而核电站把化学能转化成电能
D.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
查看答案和解析>>
科目: 来源: 题型:
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法错误的是( )
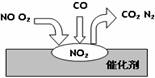
A.NO2是该过程的中间产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分包括CO和NO
D.催化转化总反应为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数,下列说法中一定正确的是( )
A.1mol甲烷中的氢原子被氯原子完全取代,需要2NA Cl2
B.常温常压下,m g乙烯与m g丙烯中均含有![]() 对共用电子对
对共用电子对
C.标准状况下,22.4LBr2中所含的分子数为NA
D.1mol?L―1Mg(NO3)2溶液中含有NO3―的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的碳原子的符号:12C B.HF的电子式:![]()
C.Cl-离子的结构示意图:![]() D.CH4分子的比例模型:
D.CH4分子的比例模型:![]()
查看答案和解析>>
科目: 来源: 题型:阅读理解
阿斯匹林(aspirin)的有效成分是乙酰水杨酸,它是19世纪末合成成功的,作为一个有效的解热止痛、治疗感冒的药物,至今仍广泛使用,有关报道表明,人们正在发现它的某些新功能。阿斯匹林是由水杨酸(邻羟基苯甲酸)与乙酸酐进行酯化反应而得的。
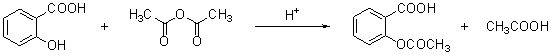
水杨酸 乙酸酐 乙酰水杨酸
(1)乙酰水杨酸的含氧官能团分别是_____________和酯基。
(2)乙酰水杨酸能在稀酸和NaOH溶液中水解。写出乙酰水杨酸与稀酸溶液共热的化学方程式:___________。
(3)写出同时符合下列四个要求的水杨酸的同分异构体: 。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH发生反应;
④只能生成两种一氯代产生。
(4)已知酚羟基遇FeC13溶液显紫色,但显色反应要在中性或弱酸性溶液进行。现要求用已有的知识检验出乙酰水杨酸分子中存在酯基。有人设计了如下的实验方案:
取一支洁净的试管,向其中加入2mL阿斯匹林清液,然后再滴入2 滴稀硫酸,将溶液在酒精灯上加热片刻后,滴入2滴FeC13溶液,振荡,无明显现象;再向其中逐滴加入Na2CO3溶液,振荡,出现了紫色。你认为逐滴加入Na2CO3溶液的目的是_____________。从此实验你得到的启示有_____________。
(5)为测定阿斯匹林中有效成分的含量,称取样品0.250 0 g ,准确加入浓度为0.1015 mol?L- NaOH溶液50.00 mL,煮沸60min。冷却后用浓度为0.1015 mol?L- 的HC1溶液返滴过量的NaOH,消耗HC1溶液记录如下:
| 数据 次数 | 1 | 2 | 3 |
| 初始读数 | 2.00 | 12.50 | 5.20 |
| 最后读数 | 27.10 | 37.40 | 33.20 |
则该产品中乙酰水杨酸的含量为(乙酰水杨酸的摩尔质量是180.16 g?mol- 。(只要求列式表示,不计算出最后结果)____________。
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
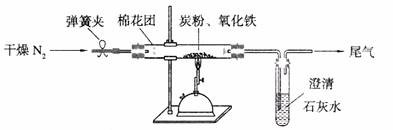
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式: 。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g氧元素为0.96g。得出原假设不成立,理由是 。
(6)得出结论:根据数据处理结果判断反应产生的气体是 ,该实验中发生的化学方程式为 。
(7)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进 。
查看答案和解析>>
科目: 来源: 题型:
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com