
科目: 来源: 题型:
下列物质的分类结果全部正确的是( )
| A | B | C | D |
| 淀粉――混合物 | 苯酚――有机物 | 液氯――非电解质 | 水晶――分子晶体 |
| 胆矾――纯净物 | 纯碱――盐 | 碳酸钙――强电解质 | 食盐晶体――离子晶体 |
| 盐酸――化合物 | 水――氧化物 | 醋酸――弱电解质 | 金刚石――原子晶体 |
查看答案和解析>>
科目: 来源: 题型:
关于食品质量安全的报道中不断有:①甲醛②苏丹红③碘酸钾④谷氨酸钠等化学名词出现。上述化学名词所提到的物质中,食品加工中允许限量使用不会引起中毒事故的是( )
A.②③④ B.②③ C.③④ D.①③
查看答案和解析>>
科目: 来源: 题型:
化学反应中通常伴随着能量变化,下列说法中错误的是( )
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
查看答案和解析>>
科目: 来源: 题型:
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z?nH2O。工业上常用的一种制备流程为:
![]()
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe的物质的量。试回答下列问题。
(1)写出在酸性介质中用NaClO3氧化FeSO4?7H2O的离子方程式。
(2)取7.51 g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过
滤、洗涤、干燥得白色沉淀10.48 g,向上述滤液中加入NH3?H2O,调节溶液pH=6,经过滤、
洗涤、干燥得Fe2O3固体2.80 g。试计算该固体聚合硫酸铁的盐基度。
(3)计算出该固体聚合硫酸铁样品的化学式。
查看答案和解析>>
科目: 来源: 题型:
Be、Mg、Ca、Sr、Ba是同族元素,该族元素单质及其化合物在材料、生命科学等方面有着重要的应用。请回答下列问题:
(1)写出Ca原子的价层电子排布式: ;
(2)①BeCl2分子中Be原子采取sp杂化成键,则其分子构型是 ,其中铍氯原子之间共价键类型是 (填序号):
a.p-pπ键 b.p-pσ键 c.s-sσ键 d.s-pσ键
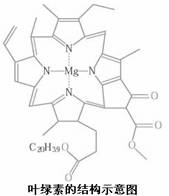
②叶绿素的结构示意图如上图左所示,中心“原子”Mg和周围的氮原子之间的键型为 ;
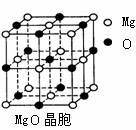
(3)MgO晶胞如上图右所示,MgO晶体中Mg2+的配位数为 。MgO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:MgO-3791kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要原因是 。MgO晶体中离子的电荷数大于NaCl,而离子间的平均距离又小于NaCl
查看答案和解析>>
科目: 来源: 题型:
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)![]() 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:
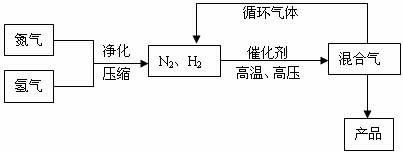
回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g); △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) ; △H=-483.6kJ/mol
则工业合成氨的热化学方程式为_______________。
(2)如果工业上,在一定温度下,将1.5molN2 气体和6molH2 气体通入到体积为1升的密闭容器中。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是______。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法?______ (填编号)。①过滤 ②蒸馏 ③渗析 ④萃取 理由是________________________。
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为:_________________________________。
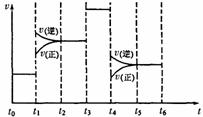
(5)如果化学反应3A2(g)+C2(g)![]() 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T℃时,将4amolA2和2a molC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数____________。
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T℃时,将4amolA2和2a molC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数____________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝?费尔和德国科学家彼得?格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如下图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。

⑴用A、B、O表示这类特殊晶体的化学式: 。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:
。(用含x的代数式表示)
⑶Mn的核外电子排布式为: 。
⑷下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如下图:

查看答案和解析>>
科目: 来源: 题型:
研究化学反应实质,探究反应规律,是提高我们化学素养的有效手段,其中“以强制弱”的规律是我们所熟知的。
(1)今有HA、H2B两种弱酸,有如下关系:H2B(少量)+A-=== HB-+HA ,则在A-、HB-、B2-离子中,最易结合质子的是 ;
(2)酸性强弱除了与物质本身属性有关外,还和溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。那么在液氨中反应:CH3COONa + HCl == NaCl + CH3COOH 能否发生,为什么? ;
(3)铝铵矾,其主要化学成分为十二水硫酸铝铵,向该盐的溶液中逐滴加入NaOH溶液,产生的现象有:
①溶液中出现白色沉淀;
②有刺激性气味的气体放出;
③白色沉淀量逐渐增多;
④白色沉淀逐渐消失;
请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(4)在氧化还原反应中,也有“以强制弱”的类似规律。已知MnO2在酸性溶液中易被还原成Mn2+, MnO2、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2 + 6FeI2 = 2FeCl3 +4FeI3 B.Cl2 + FeI2=FeCl2 +I2
C.MnO2+4HCl = MnCl2 +Cl2↑+2H2O D.2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目: 来源: 题型:
下面是某化学学习小组的实验记录,请根据实验记录(部分需要补充)回答有关问题。
【研究课题】 铜离子颜色的探究
【资料卡片】
![文本框: (1)饱和硝酸铜溶液呈深蓝色
(2)Cu2+可以和NH3形成类似[Ag(NH3)2]+的复杂离子[Cu(NH3)4]2+,NH¬3分子也可以换成其他分子或离子。](http://thumb.1010pic.com/pic1/2003/65/41/14/200365411404005514880917.files/image001.gif)
【实验探究】
| 步骤 | 实验操作 | 现象记录 |
| 1 | 观察NaCl、Na2SO4、KNO3固体颜色, 溶于水后再观察溶液的颜色。 | 固体均为无色 溶液亦均为无色 |
| 2 | 观察无水CuSO4、CuSO4?5 H2O的颜色, 分别溶于水后再观察溶液的颜色。 | 、 溶液均呈天蓝色 |
| 3 | 取2的少许溶液,加入适量NaCl晶体,观察颜色, 并一分为二,其中一份加水稀释,观察颜色。 | 黄绿色(或绿色) 又恢复天蓝色 |
| 4 | 取3中的另一份溶液,加入过量氨水,观察颜色, 加水稀释,观察颜色。 | 深蓝色 仍为深蓝色 |
【交流讨论】
(1)以上所得溶液或物质呈天蓝色的化学粒子符号是__ ____(写化学式,下同);4中呈深蓝色的化学粒子符号是__ ____。
(2)请写出实验步骤3中“其中一份加水稀释”的反应方程式: 。
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因_____________________________,设计两种不同的简单的实验方法证明你的解释:
方案①______________________________________________________________;
方案②______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知常温下:Ksp[Mg(OH)2]=1.2×10-11mol3•L-3,Ksp(AgCl)=1.8×10-10mol2•L-2
Ksp(Ag2CrO4)=1.9×10-12mol3•L-3,Ksp(CH3COOAg)=2.3×10-3mol2•L-2 下列叙述正确的
( )
A.等体积混合浓度均为0.2mol/L的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀
C.在Mg2+为0.121mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com