
科目: 来源: 题型:
1 L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2― |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如下图所示。
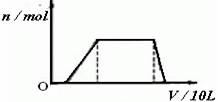
则该溶液中确定含有的离子是__________________,一定不含有的阳离子是____________,一定不存在的阴离子是__________________。
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2 ,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n (Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2 的体积为2.8 L时,溶液中发生反应的离子方程式为________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为__________________
查看答案和解析>>
科目: 来源: 题型:
晶体具有规则的几何外形,晶体中最基本和重复单位称为晶胞。NaCl的晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO的晶体密度为ρ=5.71g?cm-3,晶胞边长为4.28×10-10m。
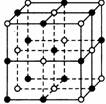
(1)FexO中x值(精确到0.01)为____________。
(2)晶体中的Fe分中Fe2+和Fe3+。其中Fe2+所占分数(用小数表示,精确到0.001)为_____________。
(3)此晶体的化学式:_______________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离为O2-围成的空间几何形状是________。
(5)在晶体中,铁元素的离子间最短距离为____________m。
查看答案和解析>>
科目: 来源: 题型:
二氧化硅晶体中,每个硅原子周围有_________个氧原子,每个氧原子周围有_________个硅原子,硅氧原子个数比为_________。若去掉二氧化硅晶体中的氧原子,且把硅原子看做碳原子,则所得空间网状结构与金刚石空间网状结构相同,试推测每个硅原子与它周围的4个氧原子所形成的空间结构为_________型;并推算二氧化硅晶体中最小的硅氧原子环上共有_________个原子。
查看答案和解析>>
科目: 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。 、 _ (不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
查看答案和解析>>
科目: 来源: 题型:
莽草酸是合成抗禽流感药物“达菲”的重要中间体,其分子式为C7H10O5。莽草酸能使溴的四氯化碳溶液褪色,等质量的莽草酸与足量的金属钠或NaHCO3反应时产生的气体体积不等。以下是以莽草酸为原料的一种合成路线(部分反应条件已省略)。

其中A分子中的羧基邻位上没有取代基,C分子中碳环上的氢被取代的一溴代物只有2种。已知有机物分子中含有![]() 或
或![]() 的结构不能稳定存在。
的结构不能稳定存在。
请回答下列问题:
(1)写出莽草酸分子中含有的官能团名称:羧基、 、 。
(2)指出反应类型:① ,③ 。
(3)写出化学反应方程式:
反应② 。
反应④ 。
查看答案和解析>>
科目: 来源: 题型:
实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口。静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:____________________________________。
(2)硫酸溶液过稀会导致______________________________________________________。
(3)采用水浴加热的原因是____________________________________________________。
(4)反应时铁屑过量的目的是(用离子方程式表示)______________________________。
(5)溶液趁热过滤的原因是____________________________________________________。
塞紧试管口的目的是______________________________________________________。
(6)静置冷却一段时间后,在试管中观察到的现象是______________________________。
查看答案和解析>>
科目: 来源: 题型:
化学实验室制取HCl气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com