
科目: 来源: 题型:
下列叙述中,正确的是 ( )
A.含有金属阳离子的晶体一定是离子晶体
B.有单质参加或生成的化学反应一定属于氧化还原反应
C.失电子难的原子,获得电子的能力越强
D.由原子构成的晶体可以是原子晶体,也可以是分子晶体
查看答案和解析>>
科目: 来源: 题型:
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质由于溶液浓度不同而能发生不同氧化还原反应的是 ( )
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
A.①③ B.③④ C.①② D.①③④
查看答案和解析>>
科目: 来源: 题型:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
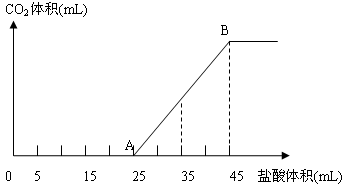
请回答:写出OA段所发生的离子方程式__________。当加入35mL盐酸时,产生二氧化碳的体积为___________mL(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
配制100mL2.0mol/LNaOH溶液时,应用托盘天平称取氢氧化钠固体的质量为 ;在用容量瓶配制溶液时,如果加水超过了刻度线,倒出一些溶液,再重新加水到刻度线。这种做法将使结果 (填“偏高”、“偏低”或“不变”);如果用2.0mol/LNaOH溶液配制100mL0.5mol/LNaOH溶液,所需的2.0mol/LNaOH溶液的体积为 。
查看答案和解析>>
科目: 来源: 题型:
为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:
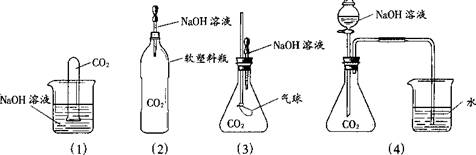
 (1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:____________。
(1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:____________。
(2)某同学质疑上述所有实验设计,该同学质疑的依据是______________________。
(3)在原实验的基础(4)上,请你设计实验证明CO2和NaOH肯定发生了化学反应。_______ ______________________________(用化学方程式表示即可)。
查看答案和解析>>
科目: 来源: 题型:
中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:_________________,在大小烧杯之间填满碎泡沫(或纸条)其作用是________________。
(2)该实验常用0.50 mol?L-1 HCl和0.55 mol?L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是___________。当室温低于10℃时进行,对实验结果会造成较大的误差其原因是___________。
(3)已知中和反应前后溶液的温度分别为t1和t2,若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g?℃),则该中和反应放出热量为______________kJ(填表达式),ΔH=___________ kJ/mol(填表达式)。
(4)1.00 L 1.00 mol?L-1 H2SO4溶液与2.00 L 1.00 mol?L-1 NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为____ ___,表示其中和热的热化学方程式为
_______ _。
查看答案和解析>>
科目: 来源: 题型:
近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质---碳纳米颗粒。这种碳纳米颗粒可用氧化汽化法提纯。其反应的化学方程式为:
__ C + ____K2Cr2O7 + ___H2SO4(稀)= __CO2 + ___K2SO4 + ___Cr2(SO4)3 + __ ____
①完成并配平上述反应的化学方程式
②此反应的氧化剂________ 。
③H2SO4在上述反应中表现出来的性质是__________(填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
④上述反应中若产生11g气体物质,则转移电子的数目为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com