
科目: 来源: 题型:
我国推广食用加碘盐。根据GB5461――《国家食用盐标准》,碘元素含量为20~50mg/kg为合格。质量监督部门为检测某品牌加碘盐是否合格,进行了如下实验:称取250g 某品牌加碘盐样品,在酸性条件下用足量KI溶液将其中IO3-全部转化成I2,生成的I2再用0.010mol/L的硫代硫酸钠溶液滴定,滴定到终点时用去24 mL。
有关反应如下:(未配平)
①IO3-+I-+H+―I2+H2O
②I2+S2O32-―I-+S4O62-
(1)写出配平了的上述两个反应方程式 、 ;
(2)用硫代硫酸钠溶液滴定I2时,应用_________作指示剂,滴定到终点的现象是________;
(3)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
查看答案和解析>>
科目: 来源: 题型:
从香料八角中提取的莽草酸是合成治疗禽流感的药物――达菲(Tamiflu)的原料之一,达菲是抗禽流感病毒特效药物。
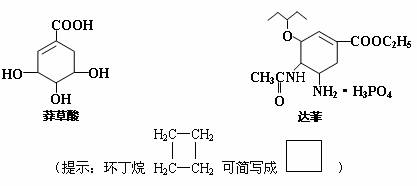
(1)莽草酸中含有的官能团有____________;(写名称)
(2)根据达菲分子的结构推测它可能发生的反应类型有:____________;
(3)请写出莽草酸与乙醇反应的化学方程式(有机物用结构简式表示):
___________________________________________;
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)
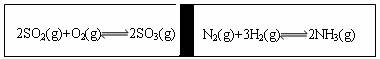
(1)若起始时两边分别投入2 mol SO2、1 mol O2;1 mol N2、3 mol H2,达到平衡后,隔板能否处于中央 (填“是”或“否”)。
(2)起始时投入2 mol SO2、1 mol O2;1 mol N2、2 mol H2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字);
(3)若起始时投入2 mol SO2、1 mol O2;1 mol N2、a mol H2、0.1 mol NH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围 。
查看答案和解析>>
科目: 来源: 题型:
某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充:
、 。
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠[Na3Co(NO2)6]反应生成黄色沉淀[K2NaCo(NO2)6],该原理可用于K+的检验。注意:NH4+也能与Na3Co(NO2)6生成黄色沉淀,会干扰K+离子的检验。
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。
查看答案和解析>>
科目: 来源: 题型:
下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,单质F常用作自来水消毒。
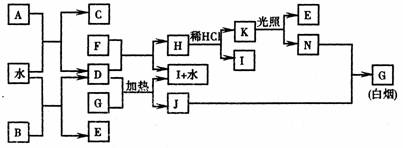
请按要求填空:
(1)A的电子式是 、B的电子式是 、
K的结构式是 、C的结构式是 ;
(2)D与G反应的化学方程式是 ;
(3)含1mol N的稀溶液与足量稀氢氧化钠溶液完全中和,放出57.3kJ的热量,则表示该反应中和热的热化学方程式为: 。
查看答案和解析>>
科目: 来源: 题型:
利用下图装置测定金属镁的相对原子质量。请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0 mol?L-1的H2SO4)
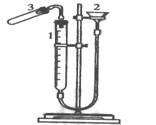 实验方法如下:
实验方法如下:
(1)加药品前要检查该装置的气密性,较简便单的方法是:
。
(2)气密性检验后,按以下步骤进行实验,请回答有关问题:
①装硫酸。取下试管,加入 mol/L的H2SO4且体积应大于 ml。
②放置镁条。为保证产生的氢气不泄漏,应将镁条放置在 。
③记下量气管起始读数V1。
④将试管竖直,使镁条滑到试管中与酸反应;
⑤记下镁条反应完后的量气管读数V2。如何读数才能减少误差 。
(3)经测定镁与酸反应产生H2的体积为V L(已折算成标准状况),则镁的相对原子质量的表达式为(相对原子质量用M表示): 。
(4)如果测得的值比实际值偏大,请你分析产生误差偏大的可能原因(假设在测得外界温度、压强以及在换算、计算过程中都没有错误。至少写2条)
① ② 。
查看答案和解析>>
科目: 来源: 题型:
(1)用已准确称量的1.06gNa2CO3固体配制0.100 mol?L-1Na2CO3溶液100mL,所需要的仪器为: ;
(2)除去KCl溶液中的SO42-离子,依次加入的试剂为(填溶质的化学式): ;
(3)如何判断SO42-离子已沉淀完全? 。
查看答案和解析>>
科目: 来源: 题型:
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:( )
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O
2PbSO4+2H2O
则下列说法正确的是:
A.充电时:阳极反应是4OH--4e-=O2↑+2H2O
B.放电时:正极反应是Pb-2e-+SO42-![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.放电时:电子流动方向由B到A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com