
科目: 来源: 题型:
在0.1mol/L NH3?H2O溶液中存在如下电离平衡:NH3?H2O ![]() NH
NH![]() +OH-。下列叙述正确的是( )
+OH-。下列叙述正确的是( )
A.加入少量浓盐酸,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1mol/L NH4Cl溶液,溶液中c(OH-)减小
D.加入少量MgSO4固体,溶液pH增大
查看答案和解析>>
科目: 来源: 题型:
离子Y的溶液中混有离子X,用试剂Z能检验离子X存在的是 ( )
| 试剂Z | 离子X | 离子Y |
| A.NH3?H2O B.Na2SO4 C.AgNO3 D.BaCl2 | Al3+ Ba2+ Cl- SO | Mg2+ Mg2+ CO Ag+ |
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是 ( )
A.质子数相同的原子一定属于同种元素
B.酸与碱中和生成1molH2O的反应热叫做中和热
C.医学上利用血清的纸上电沪进行某些疾病的诊断
D.熔融状态时能导电的晶体不一定是离子晶体
查看答案和解析>>
科目: 来源: 题型:
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(如图)。按此密闭体系中气体的流向,在A处流出的气体中除N2外,主要成分是( )
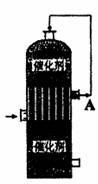
A.SO2 B.SO3、O2 C.SO2、O2 D.SO2、SO3
查看答案和解析>>
科目: 来源: 题型:
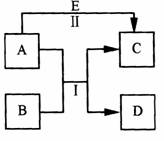 A、B、C、D、E是中学常见的五种物质,其转化关系如图所示。反应I、II均在水溶液中进行,其中某些物质可能已略去。已知D是单质,C、E是化合物。
A、B、C、D、E是中学常见的五种物质,其转化关系如图所示。反应I、II均在水溶液中进行,其中某些物质可能已略去。已知D是单质,C、E是化合物。
(1)若A是单质,其水溶液具有漂白性,D在常温
下为固态,且A、D均可使湿润的淀粉碘化钾试纸变
蓝。E是一种可溶性强碱,其焰色反应为黄色。
①A的电子式为 ;
C固态时的晶体类型为 ;
②写出反应Ⅱ的离子方程式 ;
③在E的环境中,A与B还可以发生另外一个反应,每1mol B完全反应转移6mol 电子,写出反应的化学方程式 。
(2)若B是单质,工业上用电解氧化物的方法获得B。B元素原子的电子层数等于其最外层电子数。D是无色无味的气体,E是B的最高价氧化物的水化物。
①若C溶液显酸性,其原因用离子方程式表示为 ;
②若C溶液显碱性,则反应Ⅱ的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
 (1)合成氨工业对化学工业和国防工业具有重要意义。
(1)合成氨工业对化学工业和国防工业具有重要意义。
工业合成氨生产示意图如图1所示。
①X的化学式为 ;
②图中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。图2表示随条件改变,
氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正
确的是(选填字母代号) ,当横坐标为温度时,变 化趋势正确的是(选填字母序号) 。

(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
;
;
②氨水中水电离出的c(OH-) 10-7mol/L(填写“>”、“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大以小依次为 。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1 mol B,转移电子的物质的量为 mol。
查看答案和解析>>
科目: 来源: 题型:阅读理解
工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
NH3 + CO2 + H2O + NaCl(饱和) ![]() NaHCO3(晶体)↓+ NH4Cl
NaHCO3(晶体)↓+ NH4Cl
(1)某校学生实验小组利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体。C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
可选用的药品有:a.石灰石 b.生石灰 c.6 mol/L盐酸 d.稀硫酸 e.浓氨水
f.饱和氯化钠溶液。

①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④检验D出口处是否有氨气逸出的方法是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:

①在操作II中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作III的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
查看答案和解析>>
科目: 来源: 题型:
已知化合物A的相对分子质量为182.5,其分子组成可以表示为CxHyOCl。有关转化关系如图所示:

C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为
 ,其中R、R′为烃基。
,其中R、R′为烃基。
请回答以下问题:
(1)A中含有的含氧官能团的名称是 ;
③的反应类型为 ;
(2)已知含有烃基R的有机物R―OH含氧50%,则A的化学式为 ;
(3)已知E中R′的两个取代基呈对位,则E的结构简式为 ;
(4)写出反应①的化学方程式 ;
(5)D在浓硫酸、加热的条件下反应生成F(C11H12O2),F在一定条件下可以发生加聚反应,写出该加聚反应的化学方程式 ;
(6)在B的多种同分异体中,写出分子结构中含有 , 且属于酯的同分异构体的结构简式 。
, 且属于酯的同分异构体的结构简式 。
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是 ( )
A.放射性元素的半衰期是指大量该元素的原子核中有半数发生衰变所需要的时间
B.![]() Rn(镭)衰变为
Rn(镭)衰变为![]() Rn(氡)要经过1次α衰变和1次β衰变
Rn(氡)要经过1次α衰变和1次β衰变
C.β射线是原子核外电子挣脱原子核的束缚后而形成的电子流
D.中子与质子结合成氘核的过程中需要吸收能量
查看答案和解析>>
科目: 来源: 题型:
在某无色溶液中,可能存在Na+、Ca2+、Fe3+、Br-、CO32-、SO42-、Cl-离子中的几种。某学生进行了下列实验:(1)取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;(2)一份加入AgNO3溶液,有白色沉淀产生;(3)另一份加入BaCl2溶液,有白色沉淀产生。该溶液中一定大量存在的离子组是 ( )
A.Na+、Fe3+、SO42- B.CO32-、Cl-、SO42-
C.Ca2+、Br-、SO42- D.Na+、SO42-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com