
科目: 来源: 题型:
常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
A.MnO2 CuO FeO
B.Na2CO3 NaHCO3 K2CO3
C.AgNO3 KNO3 Na2CO3
D.(NH4)2SO4 K2SO4 NH4Cl
查看答案和解析>>
科目: 来源: 题型:
接触法生产H2SO4过程,对废气、废水、废渣、“废热”的处理正确的是( )
①尾气用氨水处理;
②污水用石灰乳处理;
③废渣用来造水泥,炼铁;
④设置“废热”锅炉产生蒸气,供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液可以用一种试剂加以区别
B.合成氨工业与接触法制硫酸中SO2催化氧化的过程中都采用了高压的生产条件
C.在医院中为酸中毒病人输液不应采用0.9%氯化铵溶液
D.汽车排放的尾气中含有氮氧化物的主要原因是汽油燃烧不充分引起的
查看答案和解析>>
科目: 来源: 题型:

下图表示一些有机物之间的相互转化关系,图中B、D、E都能使溴水褪色,D不能发生银镜反应,A能发生银镜反应。
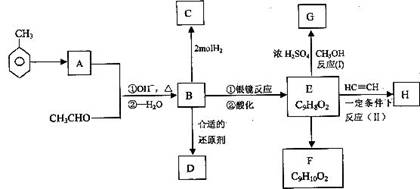
试回答:
(1)写出有机物的结构简式:B _________ H _________
(2)写出A中含氧官能团的名称 __________.反应(Ⅱ)的类型是_____________
(3)完成化学方程式:
E→G:_____________________________
B的银镜反应:______________________。
查看答案和解析>>
科目: 来源: 题型:
现有下列第2、3周期元素性质的部分数据,其中x数值是表示不同元素的原子在分子内吸引电子的能力大小,若x值越大,元素的非金属性越强,金属性越弱。X值相对较大的元素在所形成的分子中化合价为负价。
| 元素编号 元素性质 | ① | ② | ⑨ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| X | 3.44 | 2.55 | O.98 | 2.04 | 2.19 | 3.16 | O.93 | 3.04 | 1.6l | |
| 常见 化合价 | 最高价 | +4 | +1 | +3 | +1 | +3 | ||||
| 最低价 | -2 | -3 | -1 | -3 | ||||||
(1)写出元素⑥在周期表中的位置________。
(2)元素⑦和元素⑨两种元素的氢氧化物反应的离子方程式为____________________
(3)“神舟”五号飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的______________ (填序号)元素组成的。
(4)将8![]() 元素②的单质在足量的元素①的单质中燃烧,所得气体通入1Llmol?L-1的NaOH溶液中,完全吸收后,溶液中离子浓度的大小顺序是 ________。
元素②的单质在足量的元素①的单质中燃烧,所得气体通入1Llmol?L-1的NaOH溶液中,完全吸收后,溶液中离子浓度的大小顺序是 ________。
查看答案和解析>>
科目: 来源: 题型:
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第_______族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是_______(填:物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
食盐+H2O→NaOH+H2↑+C12↑(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000t,最少需消耗食盐 t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
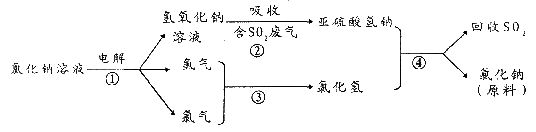
请写出②④的化学反应方程式:______________________________
查看答案和解析>>
科目: 来源: 题型:
某化学活动小组为探究氯气的制取及以氯气为原料进行特定反应,设计了下边的实验装置示意图。
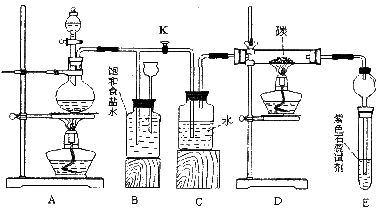
(1)为检验此装置的气密性,甲乙两同学分别设计了如下两个方案:
甲同学:在A处加热,然后根据气密性的检查标准,观察B、C、E中的有关现象进行判断。
乙同学:先关闭K,点燃A处的酒精灯,观察B中的有关现象进行判断;再打开K,点燃D处的酒精灯,根据C、E中的有关现象进行判断。
请你分析甲乙两同学的做法哪个更好,为什么?
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃D处酒精灯,连接上E装置。C12通过c瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。
试写出D中反应的化学方程式:__________,装置C的作用是___________
(3)在E处,紫色石蕊试液的颜色由紫色变红色,再变为无色,其原因是____________
(4)若将E处试管中溶液改为澄清石灰水,反应过程中现象为_______________
产生这种现象的主要原因是________________(用化学方程式表示)
(5)D处反应完毕后,关闭K,移去酒精灯,由于余热的作用,A处仍有C12产生,此时B中的现象是_________,B的作用是_____________
查看答案和解析>>
科目: 来源: 题型:阅读理解
原电池、电解(电镀)池是化学反应利用方面的典型事例,体现出能量之间的转换,受到越来越多的关注。按要求回答下列各个问题。
(1)南昌大学最近研发出一种新型纳米锂电池,已跻身国内领先地位。锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。两极的电极反应式:
负极:![]() 正极:
正极:![]() 。
。
充、放电时电池中的变化简单表示为:![]() (a、b、c、d表示充放电过程)。其中表示充电时阴极发生变化的过程是 (填a、b、c、d),判断理由是 。
(a、b、c、d表示充放电过程)。其中表示充电时阴极发生变化的过程是 (填a、b、c、d),判断理由是 。
(2)在正负极之间是固体电解质。固体电解质又称离子导体,在一定温度范围内具有很强的导电性。固体电解质虽然是固体,但却像电解质溶液一样为离子的导电载体。下列物质能作为固体电解质的是 (填编号)。
①特种钢;②硝酸钾晶体;③银;④高纯度硅。
(3)实验室中用该类电池在铁棒上镀铜,当有lmol电子发生转移时,则正极产生物质的质量为 g。
(4)为了使产品更耐腐蚀和美观,通常采用电镀的方式,但随之而来的是污染问题。某电镀厂处理有氰电镀的废水时,用Ti02作催化剂,用NaCl0将CN-离子氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成N2和C02;用如图装置实验,通过测定二氧化碳的量确定CN-的含量。将浓缩后含CN-离子200mL的污水与过量NaClO溶液的混合液,倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为_____________

②乙中除生成N2和C02外,还有HCl及副产物Cl2等。在上述装置中HCl和C12是如何被除掉的?______。
③实验后得到0.4吧沉淀,则浓缩后的污水中CN-的含量为 g/L。
查看答案和解析>>
科目: 来源: 题型:
工业上合成氨是在一定条件下进行如下反应:![]()
![]()
![]() ,其部分工艺流程如下:
,其部分工艺流程如下:

4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g) ![]() 2NH3(g)的△H=_________。
2NH3(g)的△H=_________。
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为l升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_____。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法? ____________(填编号)。①过滤 ②蒸馏 ③渗析 ④萃取
理由是 。
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为:_____________。
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水 mL,(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pn 14-a(填“大于”“小于”或“等于”)
查看答案和解析>>
科目: 来源: 题型:
通过对下图的观察,有以下几种叙述,其中不正确的是 ( )
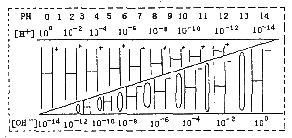
A.该温度下,不论何种水溶液中[H+] [OH-]乘积相等,即水的离子积是一个常数
B.若醋酸钠溶液中[Na+]=[CH3COO-],则溶液中的[H+]=[OH-]
C.如果定义pOH=-lg[OH-]时,则该温度下某水溶液中的pOH和pH之和等于14
D.某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com