
科目: 来源: 题型:
A、B、C、F是中学化学常见的单质,在相同条件下,气体A的密度大于气体B的密度,D为红棕色固体。其有关转化如下:

(1)①写出A与N反应的离子方程式 。
②写出C与D反应的化学方程式 。
(2)怎样检验N溶液中的阳离子,简述实验步骤 。
(3)将H的水溶液加热蒸干并灼烧,得到的固体为 (写化学式),其有关反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素的原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物ACD3与其氢化物CA3反应生成一种盐X,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。
请回答下列问题:
(1)由A、B、D、E四种元素组成的某无机化合物Y受热易分解。写出少量Y溶液与足量Ba(OH)2溶液反应的离子方程式 。
(2)将铝片和镁片用导线连接,插入由A、D、E三种元素组成的稀溶液中构成原电池,则负极的电极反应式为 。
(3)常温下,ACD3的稀溶液与CA3的水溶液混合,可能出现的结果是 。
①pH<7,c(H+)>c(CD![]() )> c(OH-)> c(CA
)> c(OH-)> c(CA![]() )
)
②pH<7,c(CD![]() ) >c(OH-)=c(H+)> c(CA
) >c(OH-)=c(H+)> c(CA![]() )
)
③①pH>7,c(CA![]() )> c(OH-) >c(CD
)> c(OH-) >c(CD![]() )>c(H+)
)>c(H+)
④①pH<=7,c(CA![]() )>c(CD
)>c(CD![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(4)对可逆反应3A2(g)+C2(g) ![]() 2CA3(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。
2CA3(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。
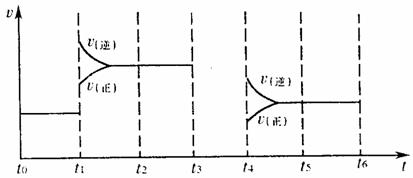
(5)温度为T℃时,将4amolA2和2amolC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则该反应的平衡常数为 。
查看答案和解析>>
科目: 来源: 题型:
根据相关的图像判断,下列说法正确的是( )
A.t0时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂
 aX(g)+bY(g)
aX(g)+bY(g) ![]() cZ(g)
cZ(g)
B.反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应
L(s)+aG(g)![]() bR(g),且a>b
bR(g),且a>b

C.物质的百分含量和温度关系如下图,则该反应的正反应为吸热反应
aA(g)+bB(g)![]() cC(g)
cC(g)

D.若该反应在850℃的10L密闭容器中进行,4min时,反应放出51.6kJ的热量
CO(g)+H2O(g)==CO2(g)+H2(g) △H=-43kJ?mol-1

查看答案和解析>>
科目: 来源: 题型:
如图,乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+3O2 2CO2+3H2O。下列说法中,不正确的是( )
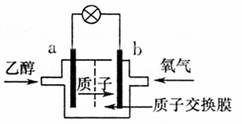
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a极上发生的电极反应是:C2H5OH+3H2O+13e-→2CO2+12H+
D.b极上发生的电极反应是4H++O2+4e-→2H2O
查看答案和解析>>
科目: 来源: 题型:
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO![]()
![]() H2CO3
H2CO3![]() CO2+H2
CO2+H2
H++PO![]()
![]() HPO
HPO![]() H++ HPO
H++ HPO![]()
![]() H2PO
H2PO![]()
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是 ( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维护pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维护pH稳定
C.某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减少,pH显著增大,可能传统引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
查看答案和解析>>
科目: 来源: 题型:
某红色固体的成分可能是氧化亚铜、铜或三氧化二铁中的一种或几种。某学校化学科研小组欲探究该红色固体的成分。请你参与该活动,并完成相关实验设计。
查资料知道,氧化亚铜是一种碱性氧化物,溶于稀硫酸生成铜和硫酸铜,在空气中加热生成氧化铜。
(1)甲同学认为,取少量固体,加入足量稀硫酸,充分搅拌后,取该溶液少量,置于一洁净的试管中,滴加硫氰化钾溶液,如溶液不变红色,证明原固体中一不定期不含三氧化二铁。你认为这种说法合理吗? 。简述你的理由(不需写出反应的方程式): 。
(2)乙同学认为,取少量固体溶液稀硫酸,若固体全部溶解,就说明一定没有铜和氧化亚铜。这种说法不合理。在此实验过程中,可能发生如下反应(用离子方程式表示):
。
(3)丙同学经分析确定该固体的成分是氧化亚铜和铜。他想通过实验测定两种物质的质量分数。请你帮他设计一个实验方案,写出实验涉及到反应的化学方程式:以a、b、c……代表实验测出相应的数据,写出氧化亚铜的质量分数的表达式。
化学方程式: 。
氧化亚铜的质量分数的表达式: 。
查看答案和解析>>
科目: 来源: 题型:
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料。
(1)写出肼与一氧化氮反应的化学方程式 。
(2)肼――空气燃料电池是一种碱性燃料电池,电解质溶液是20%―30%的KOH溶液。该电池放电时,负极的电极反应式是 。
(3)下图是一个电化学装置示意图。用肼――空气燃料电池做此装置的电源。
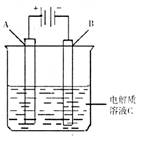
①如果A为含有铁、银、金、碳等杂质的粗铜,B为纯铜,C为CuSO4。通电一段时间后,溶液中Cu2+的浓度将 填“增大”、“减小”或“不变”)。
②如果A是铂电极,B是石墨电极,C是硫酸性,阴极的电极反应式是 。利用该装置可制得少量过氧化氢:在阳极上SO42―被氧化成S2O82―(过二氧酸根离子)S2O82―与H2O反应生成H2O2,S2O82―+2H2O=2S2O42―+H2O2+2H+。若要制取1molH2O2,该燃料电池理论上需消耗 molN2H4。
查看答案和解析>>
科目: 来源: 题型:
在一定体积的密闭容器中,发生反应A(g)+B(g)![]() C(g)+D(g),其化学平衡常数K随温度变化关系如下表:
C(g)+D(g),其化学平衡常数K随温度变化关系如下表:
| t/℃ | 800 | 900 | 1000 | 1200 |
| K | 0.9 | 1.0 | 1.7 | 2.4 |
(1)某温度下,当反应达平衡时,容顺内各物质的浓度均为Xmol?L―1,若改变温度,能否使C的平衡浓度增大到2Xmol?L―1? (填“能”或“不能”),理由是 。
(2)若起始时加入1molA和2molB,反应达平衡后,C的浓度为wmol?L―1。若保持温度和体积不变,起始时加入amolA、bmolB、cmolC、dmolD,要使平衡后C的浓度仍为w mol?L―1,则a、b、c、d之间应满足的关系是 。
查看答案和解析>>
科目: 来源: 题型:
室温下,将等体积CH3COOH溶液和NaOH溶液混合。
(1)若混合溶液中c(H+)=c(OH―),则混合前c(CH3COOH) c(NaOH),混合前CH3COOH溶液中c(H+) NaOH溶液中c(OH―)(用“大于”或“小于”或“等于”填空)。
(2)若混合溶液的溶质为CH3COONa和NaOH,则下列关系可能正确的是 。
①c(Na+)>c(CH3COO―)>c(OH―)>c(H+)
②c(Na+)>c(OH―)>c(CH3COO―)>c(H+)
③c(CH3COO―)>c(Na+)>c(OH―)>c(H+)
④c(Na+)>c(CH3COO―)> c(H+)> c(OH―)
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组的同学们共同设计了下图所示的实验装置,此装置即可用于制取气体,又可用于验证物质的某些性质。
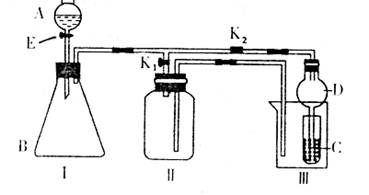
(1)若利用该装置制取并收集H2或NH3,在I中加入药品后应该进行的操作是
;若要制取并收集O2或NO,更换I中药品后,不更换仪器,只需要作简单改进,即可完成实验,其改进的方法是
。
(2)打开K2,关闭K1。
①利用该装置进行实验,可以证明以下物质的酸性强弱顺序为:HC1>H2CO3>H2SiO3。有同学认为:在A中加 ,B中加CaCO3,C中加 (均填写物质的化学式)。观察到 的现象,即可证明。但有的同学认为此实验在证明酸性H2CO3>H2SiO3时有缺陷,你认为缺陷是 。
②利用该装置可以制取C12,并在70℃时与NaOH溶液反应生成NaC1O和NaC1O3。实验方案是:在A中加浓盐酸,B中加高锰酸钾,C中加氢氧化钠溶液,烧杯中加 。待C中溶液恰好反应后,向其中加入过量KI溶液,加入醋酸调节溶液的酸性,此时只有NaC1O被还原,然后用一定浓度的Na2S2O3溶液滴定;继续向其中加入盐酸,调节溶液的酸性,此时NaC1O3被还原,再用同浓度的Na2S2O3溶液滴定。(I2+2S2O32―=S4O62―+2I―)实验结果记录如下:
| 将KI转化为I2 | 滴定I2,消耗Na2S2O3溶液的体积 |
| KI | 5.00mL |
| KI | 30.00mL |
通过表中数据计算C溶液中生成C1O―和C1O3―的物质的量之比 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com