
科目: 来源: 题型:
下列说法正确的是:( )
A.100mL 1.0mol/L的碳酸钠溶液中,CO32―数目为0.1×6.02×1023
B.常温常压下,2.24L氮气中所含分子数为0.1×6.02×1023
C.18g H2O所含分子数为6.02×1023
D.1 mol S 在O2中充分燃烧时,转移的电子数为6×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
对氨水溶液中存在的电离平衡NH3?H2O![]() NH4++OH―,下列叙述正确的是:( )
NH4++OH―,下列叙述正确的是:( )
A.加水后,溶液中n(OH―)增大
B.加入少量浓盐酸,溶液中n(OH―)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)减少
查看答案和解析>>
科目: 来源: 题型:
已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是:( )
A.实验③说明KI被氧化
B.实验②中氧化剂与还原剂的物质的量之比为2:1
C.实验①证明Cl―具有还原性
D.上述实验证明氧化性:ClO3―< Cl2<I2
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是:( )
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A.①②③ B.①④⑤ C.②③④ D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于![]() 的说法正确的是:( )
的说法正确的是:( )
A.属于金属元素 B.质子数与中子数之差为50
C.原子的核外电子数为39 D.![]() 和
和![]() 是两种不同的核素
是两种不同的核素
查看答案和解析>>
科目: 来源: 题型:
(1)黑火药是我国古代的一项发明,你知道能够直接制得炸药(或无烟火药)的有机原料吗?请举出三例(写名称) 、 、 。
(2)现欲由石油产品丙烯及必要的无机试剂合成(1)中带有甜味的有机原料,设计的第一步是:CH2=CH-CH3+Cl2![]() CH2=CH-CH2Cl+HCl,写出第三步反应的化学方程式:
CH2=CH-CH2Cl+HCl,写出第三步反应的化学方程式:
(3)已知有机物A是最简单的芳香烃,并且:
![]()
写出反应②的条件 ,反应③的化学方程式:
(4)某物质是由丙烯与水发生加成反应所得的产物M与(3)中B组成的混合物,经测定其中氧的质量分数为8%,则此混合物中氢元素的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+反应制取硝酸银.步骤如下:
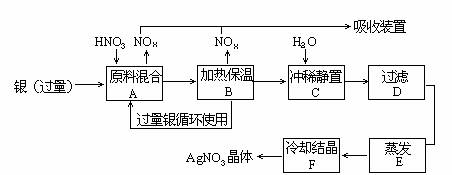
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用___________硝酸(填浓或稀).原因是___________.
(a)减少过程中产生NOx的量___________
(b)减少原料银的消耗量____________
(c)节省硝酸物质的量___________
(2)步骤B加热保温的作用是___________.
(a)有利于加快反应速度
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C是为了除去Fe3+、Cu2+等杂质.冲稀静置时发生的化学反应是___________;
(a)置换反应(b)水解反应(c)氧化―还原反应产生的沉淀物化学式:___________.
查看答案和解析>>
科目: 来源: 题型:
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用右图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
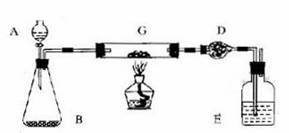
(一)实验目的:__________________________________。
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(三)实验内容:
| 实验过程 | 实验现象 | 有关化学方程式 |
| 在C中加入样品标本W克,D中装入精品后并称量为m克。连接好仪器后,检查气密性 | --------------------------------- | ---------------------------- |
| 打开A的活塞,慢慢洋加溶液。 | ||
| 对G进行加热。当G中药品充分反应后。关闭A的活塞。停止加热: | ||
| 冷却后,称量D的质量为m2克。 | --------------------- | ------------------ |
(四)计算:样品中铜的质量分数=________________(用含W、m1、m2的代数式表示)
(五)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的钢的质量分数偏小的原因可能是_______________-,在B与G之间加入的装置可以是________________,其中盛放的药品是__________________。
查看答案和解析>>
科目: 来源: 题型:
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液200 mL(其中CN-的浓度为0.05 mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
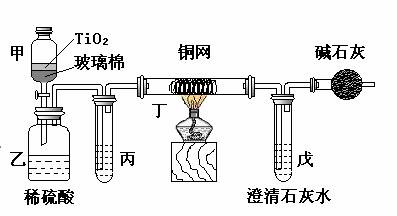
(1) 甲中反应的离子方程式为_______________;乙中反应的离子方程式为________
(2) 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。丙中加入的除杂试剂是____________(填字母)
a.饱和食盐水 b.饱和NaHCO3溶液
c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是__________________________________
(4)戊中盛有足量的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于_________________。请说明该测得值与实际处理的百分率相比偏高还是偏低?简要说明理由______________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)下列仪器中:①普通漏斗 ②天平 ③蒸馏烧瓶 ④容量瓶 ⑤燃烧匙 ⑥滴定管 ⑦分液漏斗,常用于物质分离的是___(填编号),其中根据物质沸点不同分离物质的仪器是______(填编号)。
(2)实验室有贮存以下物质的方法:A.少量白磷贮存在水中;B.碳酸钠溶液贮存在带玻璃塞的玻璃瓶中;C.少量金属钠贮存在酒精中;D.浓硝酸贮存在棕色的细口玻璃瓶中。其中正确的_______________________(填编号)。
(3)下列实验操作错误的是___________
A.检测溶液pH的操作是:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡进行比较。
B.容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水。
C.用酸滴定碱的操作是:左手摇动锥形瓶,右手控制活塞,两眼注视滴定管中溶液液面的变化。
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com