
科目: 来源: 题型:
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“=”、“<”)。
查看答案和解析>>
科目: 来源: 题型:
下表列有四种物质的沸点
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 沸点/℃ | 1465 | 1412 | 181(升华) | 57.6 |
①从表中的数据,结合学过的化学知识,你能得到的规律是 。
②以上四种物质中,属于共价化合物的是 。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl BCl3(填“>”、“=”、“<”)。
查看答案和解析>>
科目: 来源: 题型:
某草酸亚铁样品(FeC2O4?xH2O)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:
5 Fe2+ +5C2O42―+3MnO4―+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5―8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ 。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、 。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42―)== ;
FeC2O4 的质量分数为 (精确到0.01%)
查看答案和解析>>
科目: 来源: 题型:阅读理解
甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃―90℃,再逐滴滴入甲酸。
H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃―90℃,再逐滴滴入甲酸。

①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。

②装置Ⅱ的作用是 。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2?4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3== Cu(OH)2?CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2?CuCO3+4HCOOH+ 5H2O==2 Cu(HCOO)2?4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:

③步骤是将一定量CuSO4?5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是 。
④步骤是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃―80℃,如果看到 (填写实验现象),说明温度过高。
Ⅱ、甲酸铜的制备:
将Cu(OH)2?CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2―3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是 。
⑥用乙醇洗涤晶体的目的是 。
查看答案和解析>>
科目: 来源: 题型:
下列有关实验的叙述中,正确的是 (填序号)。
①将浓氨水逐滴滴入装有生石灰的烧瓶中,可以制取氨气。
②取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的
Cu(OH)2,加热,可检验蔗糖是否发生水解。
③配制一定物质的量浓度的NaCl溶液时,定容后摇匀,发现液面又低于刻度线,此时无须再加入蒸馏水。
④用小刀切取少量金属钠做实验,切剩的钠要立即放入原试剂瓶。
⑤在含I―的溶液中加入适量稀硫酸与H2O2(3%),再用酒精萃取,可以提取单质碘。
查看答案和解析>>
科目: 来源: 题型:
25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是:( )
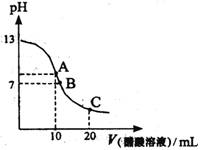
A.在A点:c(Na+)> c(OH―)> c(CH3COO―)> c(H+)
B.在A点:c(Na+)+ c(H+)=c(OH―)+c(CH3COO―)
C.在B点:c(CH3COO―)> c(Na+)> c(H+)= c(OH―)
D.在C点:c(CH3COO―)> c(Na+)> c(H+)> c(OH―)
查看答案和解析>>
科目: 来源: 题型:
关于下图所示装置的叙述,正确的是:( )
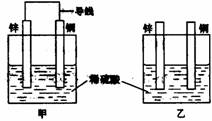
A.两装置中锌片都发生氧化反应
B.两装置中溶液的pH均增大
C.两装置中铜片的质量均逐渐减小
D.两装置中铜片表面均无气泡产生
查看答案和解析>>
科目: 来源: 题型:
半导体工业用石英砂做原料通过三个重要反应生产单质硅
![]()
![]()
![]()
![]()
![]()
![]()
生产1.00kg纯硅的总反应热为:( )
A.2.43 × 104 kJ B.―2.35 × 104 kJ
C.―2.23 × 104 kJ D.―2.14× 104 kJ
查看答案和解析>>
科目: 来源: 题型:
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) △H<0,下列叙述正确的是:( )
2Z(g)+W(s) △H<0,下列叙述正确的是:( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)==2v逆(Y)
C.达到平衡后,降低温度,正向反应速率减小的倍数小于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方法移动
查看答案和解析>>
科目: 来源: 题型:
已知甲酸钠(HCOONa)溶液呈碱性。室温下用c(H+)相同,体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,相关叙述正确的是:( )
A.加水稀释,两溶液中的氢离子数目都不变
B.用等浓度的NaOH溶液中和,盐酸比甲酸消耗的碱液少
C.跟等质量铝粉反应,盐酸比甲酸的起始反应速率快
D.跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com