
科目: 来源: 题型:
下列关于pH变化的判断正确的是( )
A.随着温度的长高,Na2CO3溶液pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,溶液pH减小
D.氢氧化钠溶液久置于空气中,溶液pH变大
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,固定容积的密闭容器中反应:2NO2(g)![]() 2NO(g)+O2(g),△H >0达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是 ( )
2NO(g)+O2(g),△H >0达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是 ( )

A.X表示温度时,Y表示NO2物质的量
B.X表示压强时,Y表示NO2的含量
C.X表示反应时间时,Y表示混合气体的密度
D.X表示NO2物质的量,Y表示O2的物质的量
查看答案和解析>>
科目: 来源: 题型:
已知25℃101kPa下,石墨和金刚石燃烧的热化学方程式如下
C(石墨)+O2(g) CO2(g); △H=-393.51kJ?mol-1
C(金刚石)+O2(g) CO2(g); △H=-395.41kJ?mol-1
下列关于C(石墨) C(金刚石)的焓变△H及有关叙述正确的是( )
A.△H >0;等质量时石墨能量比金刚石低
B.△H >0;等质量时石墨能量比金刚石高
C.△H <0;等质量时石墨能量比金刚石低
D.△H <0;等质量时石墨能量比金刚石高
查看答案和解析>>
科目: 来源: 题型:
一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下,为减慢反应的速率而又不影响氢气的量,可向其中加入 ( )
A.KCl固体 B.铁粉 C.K2SO4溶液 D.KNO3溶液
查看答案和解析>>
科目: 来源: 题型:
在理论上不能用于设计原电池的化学反应是( )
A.Al(OH)3(s)+NaOH(aq) NaAl(OH)4(aq);△H<0
B.CH3CH2OH(l)+3O2(g)→2CO2(g)+3H2O(l); △H<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g) 4Fe(OH)3; △H<0
D.H2(g)+Cl2(g) 2HCl(g); △H<0
查看答案和解析>>
科目: 来源: 题型:
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是( )
A.钢铁电化腐蚀时,负极反应为:Fe![]() Fe2++2e-
Fe2++2e-
B.AlCl3水解的离子方程式:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C.NaOH(aq)与NaHCO3(aq)反应离子方程式:HCO3-+OH- CO32-+H2O
D.氢气燃烧的热化学方程式为2H2(g)+O2(g) 2H2O(g); △H=571.6kJ?mol-1
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组对过量炭粉与氧化铁反应中气体产物的成分进行了研究。
【提出假设】该反应中的气体产物可能是CO或者是CO2和CO的混合物。
【查阅资料】氮气不与碳、氧化铁发生反应。实验室可以用饱和氯化铵溶液和饱和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气。
【设计方案】如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
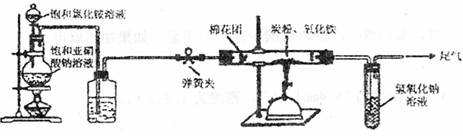
试回答下列问题:
(1)广口瓶内盛放的试剂为 ,其作用为
(2)实验开始时,应先打开弹簧夹,一段时间后关闭;再点燃酒精喷灯,理由是
(3)称取3.20g氧化铁、2.00g炭粉混合均匀,放入质量为48.48g的硬质玻璃管中;待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为51.24g。经进一步测定得知参加反应的氧元素质量为0.96g。从而确认该反应的气体产物是CO2和CO的混合物,理由是 。根据数据处理结果判断,反应产生的气体中n(CO2):n(CO)= 。
(4)有同学认为还应对该实验装置作进一步完善,你认为应作如何改进?
查看答案和解析>>
科目: 来源: 题型:
下列有某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol?L-1,密度为1.84g?cm-3
据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10―15滴(约0.5mL),加热至沸腾,该试管中液体是否有明显变化 。(填“是”或“否”)
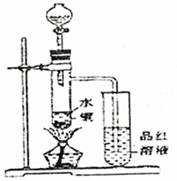
(2)甲同学再用分液漏斗加浓硫酸10mL后加热至沸腾,现象是 。
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。所观察到与甲不同的现象是 。为了最终看到与甲类似的现象,乙同学需进行的操作是: 。
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是
。
查看答案和解析>>
科目: 来源: 题型:
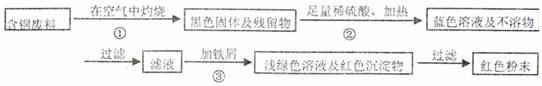
某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
方案甲:
方案乙:
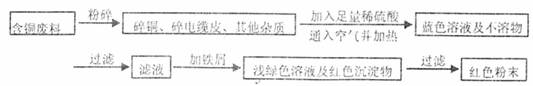
(1)两个方案哪个符合当前生产的绿色理念,为什么?
(2)写出方案甲中的②③步骤反应的离子方程式:
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简单方法检验红色粉末中是否含有过量的铁屑;如果有请你提出合理的处理方案
;
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、 、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
查看答案和解析>>
科目: 来源: 题型:
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和H2,该反应的氧化剂是 ;H2还原过程中若混O2,可能引起的后果是 。(2)下列有关硅材料的说法正确的是 (填字母)。
A.晶体硅和二氧化硅晶体的结构都类似金刚石,都常用来制造电子部件。
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承。
C.普通玻璃是由纯碱、石灰石和石英砂为原料制成的,没有固定的熔点。
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅。
(3)三硅酸镁(2MgO?3SiO2?nH2O)被用来治疗胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。写出三硅酸镁与胃酸(盐酸)反应的化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com