
科目: 来源: 题型:
下列离子方程式书写正确的是( )
A.在澄清的石灰水中通入过量的CO2 CO2+OH-=HCO![]()
B.FeSO4溶液中(已酸化)滴加双氧水 Fe2++2H2O2+4H+=Fe3++4H2O
C.Al粉与NaOH溶液反应 Al + 2OH-= AlO![]() + H2↑
+ H2↑
D.NH4HCO3溶液与过量的NaOH溶液共热 NH![]() +OH-=NH3↑+H2O
+OH-=NH3↑+H2O
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:
c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
B.0.1 mol?L-1 KHS溶液中,c(K+)=2c(S2-)+c(HS-)+c(OH- )
C.ⅠA、ⅦA族元素形成的单核离子大多不水解
D.中和pH与体积均相同的盐酸和醋酸溶液消耗NaOH的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
X、Y均为短周期元素,X原子核外各电子层的电子数之比为1∶4∶1,X比Y原子多3个电子。下列叙述中正确的是( )
A.X元素的最高氧化物对应的水化物是强碱
B.Y元素的最高氧化物对应的水化物的分子式可表示为HYO4
C.电解Y的钠盐溶液可制备Y的单质
D.Y的单质与H2O反应在同类元素中最剧烈
查看答案和解析>>
科目: 来源: 题型:
2004年美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍,且更安全。电池总反应为:C2H5OH+3O22CO2+3H2O,电池示意图如图所示。下列说法不正确的是 ( )

A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6 NA q库仑的电量
查看答案和解析>>
科目: 来源: 题型:
如下三个热化学方程式:
H2(g)+![]() (g)H2O(g) △H=a kJ?mol-1
(g)H2O(g) △H=a kJ?mol-1
H2(g)+![]() (g)H2O(l) △H=b kJ?mol-1
(g)H2O(l) △H=b kJ?mol-1
2H2(g)+O2(g)2H2O(l) △H=c kJ?mol-1
关于以上三个热化学方程式的表述中正确的是( )
①它们都是放热反应 ②a、b、c均为正值
③a=b ④b>a ⑤2b=c
A.①④⑤ B.①②④ C.①②③ D.①⑤
查看答案和解析>>
科目: 来源: 题型:
对阿伏加德罗常数NA有如下叙述:①NA是一个纯数值没有单位;②NA的单位是个;③NA度量的对象是微观粒子;④NA的单位是mol-1;⑤物质的量(n)等于微粒数(N)与NA之比。其中正确的是( )
A.①③⑤ B.②③⑤ C.③④⑤ D.②③④⑤
查看答案和解析>>
科目: 来源: 题型:
往200mL NaOH溶液中通入CO2,充分反应后,在减压和低温下,小心将溶液蒸干,得白色固体M。通入CO2的体积V(CO2)(mL)(标准状况下)与M的质量(g)的关系如下图。试通过分析和计算回答下列问题(要求写出简要计算过程):
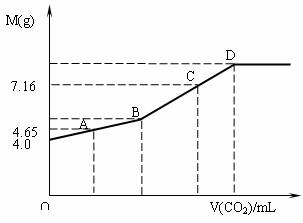
(1)B点时,白色固体M的化学式_________,通入CO2的体积为______________mL。
(2)D点时,通入CO2的体积为__________mL。
(3)C点时,通入CO2的体积为__________mL。
(4)取组成为A点的白色固体1/10,向其中逐滴加入0.1mol/LHCl溶液,请在下图中画出产生CO2气体体积(标准状况下)与所加入的盐酸的体积关系、:

查看答案和解析>>
科目: 来源: 题型:
将4 mol SO3气体和4 mol NO置于2 L容器中,在一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):
2SO3(g)![]() 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2![]() 2NO2。
2NO2。
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量是多少?(写出计算过程)
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______,或NO和________(填分子式)。
(3)若在另外一个2 L的容器中只发生反应2NO+O2![]() 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol?L-1、0.1 mol?L-1、0.2 mol?L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol?L-1、0.1 mol?L-1、0.2 mol?L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
A.c(NO)=0.35 mol?L-1或c(NO)=0.09 mol?L-1
B.c(NO2)=0.4 mol?L-1
C.c(NO2)=0.35 mol?L-1
D.c(O2)=0.2 mol?L-1或c(NO)=0.4 mol?L-1
查看答案和解析>>
科目: 来源: 题型:
实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
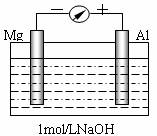
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是____(填“Mg”或“Al”)片;铝片表面产生的气泡是____;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是_________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com