
科目: 来源: 题型:
X、Y、Z、W有如下图所示的转化关系,则X、W可能是( )
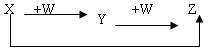
①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2
A.①②③ B.①② C.③④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
在含有大量Ba2+和![]() 的溶液中,能大量共存的离子组是( )
的溶液中,能大量共存的离子组是( )
A.H+ K+ ClO― Cl― B.H+ NH4+ Fe2+ Br―
C.NH4+ K+ Cl― ![]() D.K+ Na+ Cl― OH―
D.K+ Na+ Cl― OH―
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是( )
A.AgNO3溶液中加入过量氨水:Ag++NH3H2O===AgOH↓+NH4+
B.把0.4mol铁粉和0.8mol稀硝酸充分反应:Fe+4H++NO3―===Fe3++NO↑+2H2O
C.石灰水与Na2CO3溶液混合:Ca2++![]() ===CaCO3↓
===CaCO3↓
D.NH4HSO3溶液与足量NaOH溶液混合:HSO3―+OH―====SO32-+ H2O
查看答案和解析>>
科目: 来源: 题型:
下述实验能达到预期目的的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 金属钠投入硫酸铜溶液中 | 置换出铜 |
| B | 向硫酸铝溶液中滴加过量氨水 | 制取氢氧化铝 |
| C | 将氯化铁溶液加热蒸发 | 制氯化铁晶体 |
| D | 把铜和银用导线连接后插入稀硫酸中 | 组成原电池验证铜比银活泼 |
查看答案和解析>>
科目: 来源: 题型:
阿伏伽德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A.2.24LCl2中含有的原子数一定为0.2×6.02×1023
B.0.1L2mol?L-1的Na2CO3溶液中含有CO32-数目为0.2×6.02×1023
C.0.88gC3H8中含有的共价键总数为0.2×6.02×1023
D.7.8g过氧化钠粉末与水反应转移的电子数为0.2×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
下列药品保存方法正确的是( )
A.白磷保存在煤油中 B.在氯化亚铁试剂中加盐酸和铁粉
C.金属钾保存在CCl4中 D.过氧化钠保存配有玻璃塞的广口试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
2008年的诺贝尔化学奖被三位科学家(见下图)共同获得,以表彰他们在“发现和研究绿色荧光蛋白(green fluorescent protein 简称GFP)方面做出的贡献”。GFP需要在氧化状态下产生荧光,强化还原剂能使GFP转变为非荧光形式,但一旦重新暴露在空气或氧气中,GFP荧光便立即得到恢复。下列说法不正确的是( )

A.GFP是有氨基酸构成的能发出荧光的一类特殊蛋白质
B.可用GFP标记需要研究的蛋白质,研究特定的反应
C.GFP的发光是将化学能转化为光能
D.GFP产生荧光不受外界环境影响
查看答案和解析>>
科目: 来源: 题型:
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:

其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨
(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程)
查看答案和解析>>
科目: 来源: 题型:
有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) ![]() xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:(1)甲平衡时A的体积分数为 ;
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:(1)甲平衡时A的体积分数为 ;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”)。
(3)若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)平= 。
(4)若x=4,则W% 40% (填“大于”、“小于”或“等于”,下同);平衡时乙中的c(A) 甲中的c(A)。
查看答案和解析>>
科目: 来源: 题型:
汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
(1)下图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)为 (填“吸热”或“放热”)反应。
2NO(g)为 (填“吸热”或“放热”)反应。
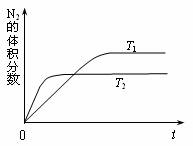
(2)2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K= 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
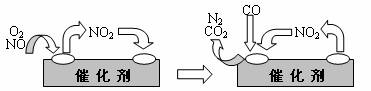
写出上述变化中的总化学反应方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com