
科目: 来源: 题型:
将石墨置于熔融的钾或气态钾中,石墨会吸收钾而形成称为钾石墨的物质,其组成是C8K、C24K、C36K、C48K和C60K。在钾石墨中,钾原子把最外层电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。在钾石墨中,钾元素处于石墨层中间,因而石墨层之间被胀大,层间的距离增加。下列对钾石墨的叙述中正确的是 ( )
A.钾石墨是一类离子化合物 B.钾石墨导电性比石墨弱
C.钾石墨与水相遇不发生任何反应 D.题干中的5种钾石墨属于同素异形体
查看答案和解析>>
科目: 来源: 题型:
下列实验操作中,仪器需插入液面下的有:( )
①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;
②制备氢气,简易装置中长颈漏斗的下端管口;
③分馏石油时测量温度所用的温度计;
④用乙醇制备乙烯时所用的温度计;
⑤用水吸收氨气时的导气管;
⑥向试管中的BaCl2溶液中滴加稀硫酸。
A.③⑤⑥ B.②⑤ C.①②④ D.①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述错误的是( )
A.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.一定温度下,1L0.5mol?L-1NH4Cl溶液与2L0.25mol?L-1NH4Cl溶液中含NH4+物质的量不同
查看答案和解析>>
科目: 来源: 题型:
下列文字表述与反应方程式对应且正确的是( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br―+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.用惰性电极电解饱和氯化钠溶液:2Cl―+2H+ ![]() H2↑+ Cl2↑
H2↑+ Cl2↑
D.实验室用液溴和苯在催化剂作用下制溴苯:![]()
查看答案和解析>>
科目: 来源: 题型:
化学与生活、社会密切相关。下列说法不正确的是( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
查看答案和解析>>
科目: 来源: 题型:
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2![]() 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.生高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
查看答案和解析>>
科目: 来源: 题型:
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: NaBr+H2SO4![]() HBr+NaHSO4 ① R-OH+HBr
HBr+NaHSO4 ① R-OH+HBr![]() R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br―被浓硫酸氧化为Br2等。有关数据列表如下;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g?cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 ;(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”);其原因是 。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层” 或“下层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
苯丙酸诺龙是一种兴奋剂,结构简式为:

(1)由苯丙酸诺龙的结构推测,它能 (填代号)。
a.使溴的四氯化碳溶液褪色
b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应
d.与Na2CO3溶液作用生成CO2
苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:

据以上信息回答(2)~(4)题:
(2)B→D的反应类型是 ;
(3)C的结构简式为 ;
(4)F→G的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生产盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素离子的结构示意图是 。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是 。(填化学式),B的10电子氢化物的分子空间构型为 。
(3)B与E可形成离子化合物BE5、BE5的电子式是 ,含有的化学键类型有 。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物结构是 (填字母标号a或b)
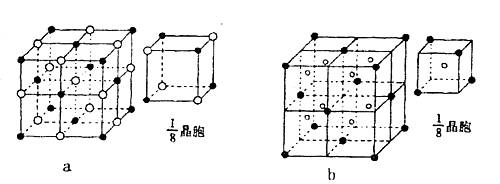
查看答案和解析>>
科目: 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为:8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放,b.用于制备硫酸,c.用纯碱溶液吸收制Na2SO4,d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。 、
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 ;
b.选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 ;证明炉渣中含有FeO的实验现象为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com