
科目: 来源: 题型:
信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是( )
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前,中、美、日等国掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
查看答案和解析>>
科目: 来源: 题型:
下表列出了前20号元素中的某些元素性质的有关数据:

(1)以上10种元素形成的单质中,与水反应最剧烈的金属是 (填写编号),非金属性格最强的是 ;
(2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为 、 。
(3)某元素R的原子半径为1.02×10-10m,该元素是 ;其电子排布式为________________ ;
(4)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。

查看答案和解析>>
科目: 来源: 题型:
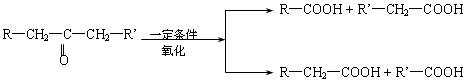
已知:A的结构简式为:CH3―CH(OH)―CH2―COOH ,现将A进行如下反应,B不能发生银镜反应, D是食醋的主要成分, F中含有甲基,并且可以使溴水褪色。
(1)写出C、E的结构简式:C_________ _、E_______ ;
(2)反应①和②的反应类型:①____________反应、②____________ 反应;
(3)写出下列化学方程式:
② F→G:_________________________________________________ ;
③ A→H:_________________________________________________ ;
查看答案和解析>>
科目: 来源: 题型:
氟化钠是一种用于农作物杀菌、杀虫剂和木材的防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;

已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为2g,Na2SiF6微溶于水:
(1)流程①中H2SiF6和NH4HCO3反应得到的NH4F与H2SiO3组成浑浊液,请写出流程②中相关反应的化学方程式:② ;能够发生上述反应的原因: 。
(2)操作I和IV是相同的,请指出其名称 ;
(3)操作II中洗涤沉淀的过程是将漏斗中母液全部滤出后,
;
(4)流程①中NH4HCO3必须过量,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) ![]() CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为: ; (2) 该反应的正反应为 反应(“吸热”或“放热”);
(3)能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4)在850℃时,可逆反应:CO2(g)+ H2(g)![]() CO(g)+ H2O(g),在该容器内各物质的浓度变化如下:
CO(g)+ H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
计算:3min―4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
查看答案和解析>>
科目: 来源: 题型:
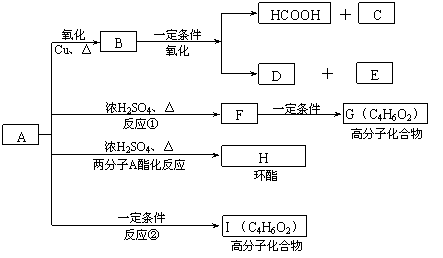
2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。如图表示两个丙烯分子进行烯烃换位,生成两个新的烯烃分子:2―丁烯和乙烯。


现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;

(1)反应①的类型:____________反应 ; G的结构简式:______________ ;
(2)反应②的化学方程式是___________________________________________ ;
(3)反应④中C与HCl气体在一定条件只发生加成反应,反应④和⑤不能调换的原因是___________________________________,E的结构简式:_____________ ;
(4)反应⑨的化学方程式:___________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ?mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ?mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ?mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ?mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg ![]() HgBr2+H2
HgBr2+H2
③HgBr2+CaO ![]() HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO ![]() 2Hg+O2↑
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
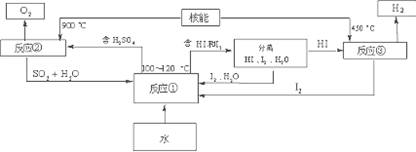
请写出反应①的化学方程式: ;
该法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
查看答案和解析>>
科目: 来源: 题型:
钼(元素符号Mo)是银灰色的难熔金属,常见化合价为+6、+5、+4,常温下钼在空气中很稳定,高于600 ℃时很快地氧化生成三氧化钼(MoO3);
辉钼精矿(主要成分为MoS2)是生产钼的主要原料。制取过程包括氧化焙烧,三氧化钼、钼粉和致密钼的制取等主要步骤,工艺流程如图:
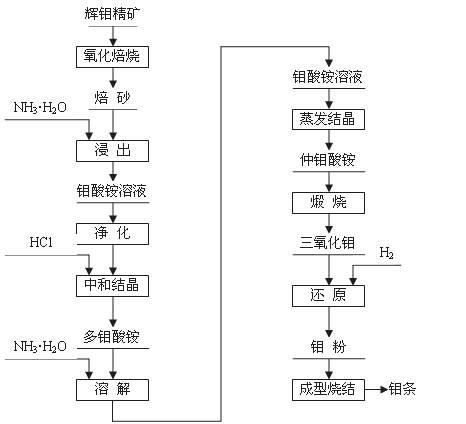
(1)辉钼精矿在600℃下进行氧化焙烧 转化为MoO3,同时产生SO2气体。主要反应的化学方程式为: 。钼冶炼厂对大气的污染主要来自于 ,你认为利用并处理该副产物的最好措施是
;
(2)三氧化钼的制取
将焙砂(主要成分:MoO3)用氨水浸出,与氨水反应生成钼酸铵[(NH4)2MoO4]溶液:反应的离子方程式为: ;
该反应: (填是或不是)氧化还原反应。
将所得钼酸铵[(NH4)2MoO4]溶液加热到55~65 ℃,用盐酸调节至溶液的pH为2,搅拌析出多钼酸铵[(NH4)2O?mMoO3?nH2O]晶体;为除去钙、镁、钠等杂质,将多钼酸铵重新溶于氨水形成钼酸铵,使氨挥发后生成仲钼酸铵晶体[(NH4)2O?7MoO3?4H2O],将仲钼酸铵晶体脱水、煅烧得纯度为99.95%的三氧化钼(MoO3)。
(3)金属钼粉的生产:
工业上在管状电炉中用氢气分两步还原三氧化钼得到钼粉:
① 在450~650℃下: MoO3 + 3H2 === MoO2 + 3H2O
② 在900~950 ℃下:MoO2 + 2H2 === Mo + 2H2O
某同学根据上述还原原理,认为还可用 等还原剂还原MoO3得到钼粉。
查看答案和解析>>
科目: 来源: 题型:
某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
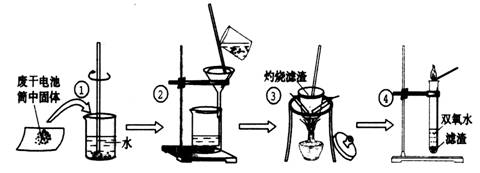
(1) 操作②中过滤时玻璃棒的作用: ;
(2) 操作④加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,试管中发生反应的化学方程式: ;
(3) 操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为: 。
(4) 已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
(一)[猜想I]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]: (“填猜想I成立”或“填猜想I不成立”);
(二) [猜想II]:主要成分为氯化锌;
[验证(操作)过程]:
;
[实验现象]:
;
[判断猜想]:猜想Ⅱ成立;
由上述实验得出的结论是:滤液中的主次成分: .
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同周期,C、D、E同处另一周期,C、A可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙,B是最活泼的非金属元素,D是地壳中含量最高的金属元素,E的最高价氧化物对应的水化物是最强的含氧酸之一。
(1)B在周期表中的位置:第 周期、第 族,E的元素符号为_______ ;
(2)物质乙可用于潜艇或航天飞机作供氧剂,写出乙与CO2反应的化学方程式:
____________________________ ;
(3)单质D与C的最高价氧化物对应水化物溶液反应的离子方程式:
______________________________________________________________________ ;
(4)1 mol 单质B的气体与1 mol C的氢氧化物在一定条件下恰好完全反应,生成一种盐、水及另一种气体,则所得气体的化学式为:__________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com