
科目: 来源: 题型:
实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是( )
A.向FeCl3稀溶液中滴加NaOH溶液,并加热至沸腾,制备Fe(OH)3胶体
B.不慎将NaOH溶液溅到皮肤上,应立即用较多的水冲洗
C.用pH计测定中和滴定时溶液中的pH变化,临近滴定终点,每加一滴测一次
D.用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出
查看答案和解析>>
科目: 来源: 题型:
化学与生活密切相关,下列有关做法正确的是( )
A.为增加明矾净水效果,可同时加入氢氧化钡溶液
B.为防止铁制品生锈,可在铁制品的外层涂油漆或局部镀铜
C.为增加Na2CO3的除油污效果,可使用热水洗涤
D.为防止植物油脂氧化,可将植物油脂露置于日光下
查看答案和解析>>
科目: 来源: 题型:
生物质能是绿色植物通过叶绿体将太阳能转化为化学能而贮存在生物质内部的能量,它一直是人类赖以生存的重要能源。下列有关说法不正确的是( )
A.生物质能是可再生性能源
B.沼气是由生物质能转换而来化石能源,其主要成分是碳氢化合物
C.乙醇汽油是混合型能源,乙醇可由富含淀粉的谷物发酵产生
D.用油料作物生产的“生物柴油”成分与从石油中提取的柴油成分相同
查看答案和解析>>
科目: 来源: 题型:
乙醛与银氨溶液的反应常因条件控制不当,会出现黑色浊液、长时间没有银折出、析出的银镜不均匀或发暗等现象,影响了银镜反应的效果。
某研究小组为探究乙醛发生银镜反应的最佳实验条件,进行了有关实验,相关数据如下表:
|
实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间/min |
| 1 | 1 | 3 | 50 | 11 | t1 |
| 2 | 1 | 3 | 65 | 11 | t2 |
| 3 | 1 | 5 | 65 | 11 | t3 |
| 4 | 1 | 5 | 65 | 4 | 无银镜 |
| 5 | 1 | 5 | 65 | 10 | t5 |
| 6 | 3 | 3 | 20 | 10 | t6 |
请回答下列问题:
(1)写出乙醛与银氨溶液发生银镜反应的化学方程式 。
(2)若只进行实验1和实验2,其探究目的是 。
(3)实验 (填序号)组合,可探究混合液pH对银镜反应的影响。
(4)实验4无银镜出现的原因是 。
(5)试管内壁的银镜用硝酸洗涤,可以回收硝酸银溶液。你认为选用 (填“浓硝酸”或“稀硝酸”)较好,理由是 。
查看答案和解析>>
科目: 来源: 题型:
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)配合物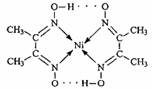 分子内的作用力有 (填编号)。
分子内的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡C③ ![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO分子的立体结构为 形。
、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO分子的立体结构为 形。
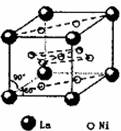
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如下图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水试样10.00mL加水稀释至100mL,加入10.0mL一定浓度的KBrO3和KBr的混合溶液,立即加入5mL盐酸,摇匀后加入1gKI固体(足量),再摇匀,放置5min。用0.01000mol/Lna2S2O3标准溶液滴定至淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去,用去Na2S2O3标准溶液14.46mL。同时以水代替污水试样做对比实验,用去Na2S2O3标准溶液38.46mL。
(1)已知上述实验中发生的反应有: KBrO3+5KBr+6HCl=3Br2+3H2O+6KCl
2Na2S2O3+I2=Na2S4O6+2NaI
请写出实验中还涉及的另两个反应的化学方程式: 、 。
(2)试计算此污水中苯酚的含量(以mg/L表示,苯酚的相对分子质量为94.00)。
查看答案和解析>>
科目: 来源: 题型:
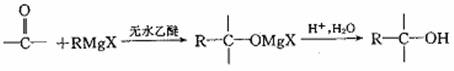
已知:I.在一定条件下,一些含羰基的化合物能发生如下反应:

II.格氏试剂(RMgX,X表示卤原子)与含羰基的化合物能发生如下反应:
(1)以柠檬醛为原料,按以下反应流程图合成维生素A:
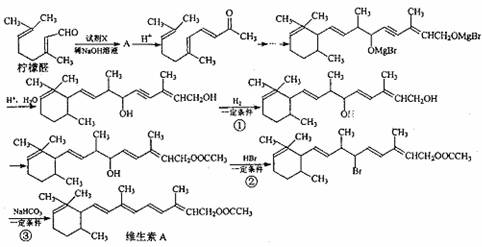
上述流程中,试剂X的结构简式为 ,①、②、③的反应类型分别是 、
、 。
(2)利用题目所给信息和学过的反应原理,以![]() 、CH3CHO和CH3MgBr为有机原料(其他无机试剂任选),可以分5步合成
、CH3CHO和CH3MgBr为有机原料(其他无机试剂任选),可以分5步合成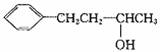 ,用反应流程图表示
,用反应流程图表示
。
(3)![]() 有多种同分异构体,其中属于酚类且苯环上只有两个对位基的同分异构体共有 种。
有多种同分异构体,其中属于酚类且苯环上只有两个对位基的同分异构体共有 种。
查看答案和解析>>
科目: 来源: 题型:
二氧化氯(ClO2)被称作第四代杀菌消毒剂。
(1)工业上用NaCl还原NaClO3生产ClO2的工艺流程如下图所示:
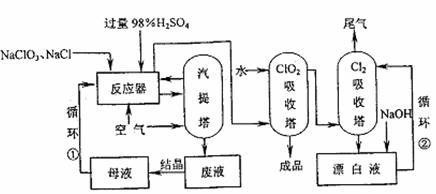
①反应器中发生反应的化学方程式为:
2NaClO3+2NaCl+2H2SO4=2ClO2↑+Cl2↑+2Na2SO4+2H2O
生产中将NaClO3和NaCl按物质的量之比1:1.05的混合水溶液加入反应器,NaCl稍过量的目的是 。
②反应器中生成的ClO2和Cl2由通入空气驱出进入ClO2吸收塔,产生的混合液进入汽提塔,汽提塔排出的废液成分主要是 (填化学式,下同)。
③以上生产流程中循环②循环利用的物质是 。
④为提高ClO2的产量,可用亚氯酸钠(NaClO2)与反应器中Cl2反应生成ClO2,该反应的化学方程式为 。尾气中的Cl2可用SO2水溶液吸收,该反应的化学方程式为 。
(2)用阳离子交换膜分隔的电解池电解450g/L NaClO2溶液,可在阳极室产生ClO2,在阴极室产生H2和NaOH。下列有关说法正确的是 (填字母符号)。
A.电解时电子流向为:电源负极→导线→阴极,阳极→导线→电源正极
B.在电解过程中,Na+向阳极移动,ClO2― 向阴极移动
C.在电解过程中阳极周围的pH基本不变
D.电解的离子方程式可表示为:2ClO2―+2H2O ![]() 2ClO2↑+H2↑+2OH―
2ClO2↑+H2↑+2OH―
查看答案和解析>>
科目: 来源: 题型:
在一定条件下进行如下反应: aX(g)+bY(g) ![]() cZ(g)下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。
cZ(g)下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。
①写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填“增大”、“减少”、或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (填序号)
A.X的转化率越高 B.反应进行得越完全
C.达到平衡时X的浓度越大 D.化学反应速率越快
②如下图所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲、乙两容器的初始体积均为1L。甲、乙容器达到平衡所用时间:甲 乙(填“>”、“<”或“=”,下同),平衡时X和Y的转化率:甲 乙。
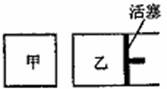
查看答案和解析>>
科目: 来源: 题型:
土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4?2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com