
科目: 来源: 题型:
氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1mol B,转移电子的物质的量为 mol。
查看答案和解析>>
科目: 来源: 题型:
常温下氨气极易溶于水,其水溶液可以导电,氨气属于 (填“电解质”或“非电解质”)。
①用方程式表示氨气溶于水的过程中存在的可逆过程
。
②氨水中水电离出的c(OH-) 10-7 mol?L-1(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为
。
查看答案和解析>>
科目: 来源: 题型:
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2 g | 15.7 g | 27.6 g |
| V(CO2)(标况) | 2.24 L | 3.36 L | 3.36 L |
则下列分析推理中不正确的是( )
A.盐酸的物质的量浓度为3.0 mol?L-1
B.根据表中数据可以计算出混合物中NaHCO3的质量分数
C.加入混合物9.2 g时盐酸过量
D.15.7 g混合物恰好与盐酸完全反应
查看答案和解析>>
科目: 来源: 题型:
下列有关说法正确的是( )
A.碘化亚铁溶液中通入少量氯气的离子方程式为:2Fe2++ Cl2= 2Cl- +2Fe3+
B.对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g), 若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.45倍,则m+n>p+q
pC(g)+qD(g), 若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.45倍,则m+n>p+q
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动,但难溶物的溶度积常数不一定改变
D.在强碱性溶液中,ClO-、Na+、S2-、Cl-可以大量共存
查看答案和解析>>
科目: 来源: 题型:
下列有关说法正确的是 ( )
A.火法炼铜的反应为Cu2S+O2![]() 2Cu+SO2,此反应中Cu2S只作氧化剂
2Cu+SO2,此反应中Cu2S只作氧化剂
B.由海水制淡水可用太阳能蒸发的方法
C.汽油中掺入酒精作为燃料不可能减少污染
D.1mol乙酸与乙醇在一定条件下发生酯化反应,可生成1mol乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
下图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用( )
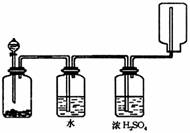
A.二氧化锰和双氧水反应生成氧气
B.浓氨水和生石灰混合生成氨气
C.Na2SO3和浓H2SO4混合生成SO2
D.锌粒与稀盐酸混合生成H2
查看答案和解析>>
科目: 来源: 题型:
NA为阿伏加德罗常数,下列说法中正确的是( )
A.1mol NaHSO4固体中含阴阳离子数为3NA
B.1mol Na2O2与水完全反应,转移电子数为NA
C.1L 1 mol?L-1Na2CO3溶液中CO32-数为NA
D.标准状况下,2mol SO3所占的体积约为44.8升
查看答案和解析>>
科目: 来源: 题型:
下列有关说法正确的是( )
A.MgCl2、聚氯乙烯、HD均为化合物
B.干馏、常压分馏、萃取都是物理变化
C.明矾、冰醋酸、硫酸钡和干冰均为电解质
D.质子数相同、电子数也相同的粒子,不可能是一种分子和一种离子
查看答案和解析>>
科目: 来源: 题型:
2008年北京奥运会“祥云”火炬用的是环保型燃料――丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知常压下1 mol丙烷完全燃烧生成稳定氧化物时放出的热量为2221.5kJ,下列有关说法正确的是( )
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ.mol-1
查看答案和解析>>
科目: 来源: 题型:
卤代烃R―Cl在一定条件下可发生如下的反应:R―Cl+KCN→R―CN+KCl
R―CN+2H2O+H+→R―COOH+NH4+,以乙烯为原料经过下图所示的反应可制取有机物w(A、B、C、D、E均为烃的衍生物)
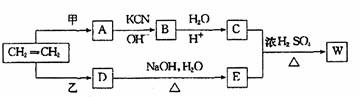
(1)若甲为Cl2,乙为HCl,A和D两种物质的关系是
①同一物质 ②同系物 ③同分异构体 ④以上都不对
(2)若甲为HCl,乙为Cl2,生成物W的分子式为C5H10O3,则W的结构简式为
。
(3)若甲为Cl2,乙为Br2。按下列要求写出C+E→W的化学方程式:
①W为最小环状分子 。
②W为高分子 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com