
科目: 来源: 题型:
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干离子组成。取该溶液进行以下反应:
① 取适量试液,加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀;
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
(1)溶液中一定不存在的离子是 ;
(2)溶液中一定存在的离子是 ;
(3)向沉淀乙中加入过量盐酸,现象是 ;
该反应的离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:
某一反应体系中存在以下五种物质:
Na3AsO3、H2O、I2、Na3AsO4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目: ;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应反方向进行,此时体系中的氧化反应为由 → 。如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是 ;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关。下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号) 。
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Fe与H2SO4溶液
查看答案和解析>>
科目: 来源: 题型:
下图所示A~H为实验室常见的仪器、装置(部分固定夹持装置略去),请根据要求回答下列各题。
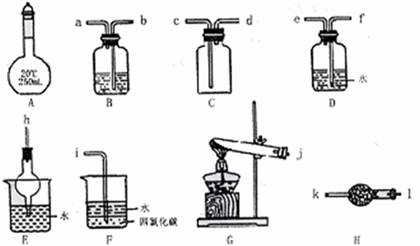
(1)A仪器的名称是 ,常用于 ;
(2)预除去CO2气体中混有的少量SO2,可选用 装置(填装置符号),该装置中盛放的试剂可以是 ;
(3)用图示仪器设计一套制取纯净、干燥的氨气的装置,仪器的连接顺序是(用管口字母符号表示)j接 。
查看答案和解析>>
科目: 来源: 题型:
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
下列分析推理不正确的是( )
A.盐酸的物质的量浓度为3.0mol?L-1
B.加入混合物9.2g时盐酸过量
C.根据表中数据不能计算出混合物中NaHCO3的质量分数
D.该混合物中NaHCO3和KHCO3的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
对于可逆反应mA(g) + nB(g) ![]() pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种v t图像如下图:
pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种v t图像如下图:
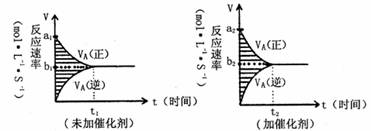
如下关系正确的为( )
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2
⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
查看答案和解析>>
科目: 来源: 题型:
425℃时,在两个相同的密闭容器中进行反应H2+I2 ![]() 2HI并达到平衡,得到图像分别如(I)、(II)所示,下列说法不正确的是( )
2HI并达到平衡,得到图像分别如(I)、(II)所示,下列说法不正确的是( )

A.平衡时两容器中相应各成分的百分含量相同,属于等效平衡
B.图(I)所示平衡时H2(或I2)的转化率为79%
C.两容器中起始加入的物质相同,平衡时达到相同的平衡状态
D.平衡时两容器中H2、I2和HI的物质的量之比均为21:21:158
查看答案和解析>>
科目: 来源: 题型:
已知H2A为二元弱酸,有下列四种溶液:
①0.01 mol/L的H2A溶液
②0.01 mol/L的NaHA溶液
③0.02 mol/LHCl溶液和0.04 mol/LNaHA溶液的等体积混合液
④0.02 mol/LNaOH溶液与0.02 mol/LNaHA溶液的等体积混合液
四种溶液中H+的物质的量浓度按由大到小的顺序排列正确的是 ( )
A.①>③>②>④ B.③>①>②>④ C.④>②>③>① D.①>②>③>④
查看答案和解析>>
科目: 来源: 题型:
下列各组气体中,两种气体的分子数一定相等的是( )
A.压强相同,体积相同的CO和H2
B.相同温度下,1 LH2和1 LCO、O2的混合气
C.质量相等、密度不等的N2和C2H4
D.体积相等,密度不等的N2和CO
查看答案和解析>>
科目: 来源: 题型:
A元素的原子最外层电子数是a,次外层电子数是b;B元素原子的M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化合物可表示为 ( )
A.B3A2 B.AB2 C.A3B2 D.BA2
查看答案和解析>>
科目: 来源: 题型:
电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常用铅蓄电池,反应原理为:PbO2+Pb+2H2SO4 ![]() 2PbSO↓+2H2O下列叙述中正确的是( )
2PbSO↓+2H2O下列叙述中正确的是( )
A.放电时PbO2是电池的负极,电解质溶液的密度逐渐减小
B.放电时负极的电极反应式为:Pb+SO42--2e-= PbSO4↓
C.电池充电时,PbO2得电子被氧化
D.电池充电时,阴极电极反应式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com