
科目: 来源: 题型:
水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染程度的标志之一。检测水中的NO2-可用目视比色法(比较溶液颜色深浅度以测定所含有色物质浓度的方法),检测步骤如下:
步骤一:配制标准溶液:称取0.69gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
步骤二:配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具有塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.30g)氨基苯磺酸粉末,实验结果如下表所示。
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积/mL | 0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
步骤三:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
①利用步骤三在野外检测水样污染程度的优点是 。
②步骤二中设计色阶序号1的作用是 。
③如果水样显色后比6号还深,应采取的措施是 。
查看答案和解析>>
科目: 来源: 题型:
环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH―。又有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
写出镁和含NO3-的废水反应的离子方程式____________________ 。
查看答案和解析>>
科目: 来源: 题型:
如下图所示的各物质的相互转变中,反应①、②是重要的工业反应,A的相对分子质量为120。X被人体吸入会与血红蛋白结合而使人中毒,Y会造成温室效应,D会形成酸雨,E是常见的金属,F分子的结构与Y分子的结构相似,且F的相对分子质量为60。

回答下列问题:
(1)反应①的化学方程式为: 。
(2)反应②的化学方程式为: 。
(3)写出F的结构式: 。
(4)Y与H2在一定条件下可生成多种物质,既可获得经济效益,也可减轻对环境的污染。
①若G是一种燃料,其相对分子质量与B的相对分子质量相等,则G的分子式为: 。
②若G是Y与H2按1∶3的比例反应而得,则G可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
查看答案和解析>>
科目: 来源: 题型:
海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。

回答下列问题:
(1)流程图中操作a的名称为 。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是 (填化学式)。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②操作b是在 气氛中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
在化学分析中,为了测定某试样中FeSO4?7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol?L-1的高锰酸钾溶液500 mL。
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度。经标定,c(KMnO4)=1.6×10―2mol/L
步骤三:称取FeSO4?7H2O试样1.073g,放入锥形瓶中,加入适量的水溶解。
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、___________ 、 。
(2)步骤二中需要对m的大致值进行预估,你预估的依据是
_______________________________________________ 。
(3)本实验中操作滴定管的以下图示,正确的是______________(填编号)。
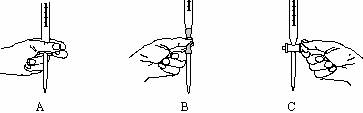
(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_________ 。
(5)请在下面空白处设计步骤四中的数据记录和数据处理表格(不必填数据)。
(6)国家标准规定FeSO4?7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品100.5%≥w ≥99.00%;三级品 101.0%≥w≥98.00%。试判断该试样符合国家________级品标准。
(7)测定试样中FeSO4?7H2O的含量时,有时测定值会超过100%,其原因可能是 ________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列判断中正确的是 ( )
A.XeF2分子中各原子均达到八电子结构
B.XeF6分子中Xe的化合价为+6价
C.上述反应中氧化剂和还原剂的物质的量之比为1∶2
D.XeF4按已知方式水解,每生成4molXe,转移12mol电子
查看答案和解析>>
科目: 来源: 题型:
可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是 ( )
2SO3(g) △H<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是 ( )

A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目: 来源: 题型:
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ ![]() AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。

下列叙述中正确的是( )
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2 +2e-=2I-
查看答案和解析>>
科目: 来源: 题型:
某无色溶液中可能含有K+、Fe3+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生。⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是( )
A.肯定不存在的离子是Fe3+、Cu2+、CO32-、Br-
B.肯定存在的离子是K+、SO42-、SO32-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断也无影响。
查看答案和解析>>
科目: 来源: 题型:
己烯雌酚是一种激素类药物,其结构简式如下图所示,下列有关叙述中错误的是( )
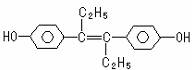
A.己烯雌酚分子中碳原子的杂化轨道方式有sp2和sp3两种
B.己烯雌酚分子中所有的碳原子都可能在一个平面内
C.1mol己烯雌酚分子与溴水完全反应时,最多可消耗4molBr2
D.1mol己烯雌酚分子与氢气在一定条件下完全反应时,最多可消耗7molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com