
科目: 来源: 题型:
工业纯碱中常含有少量NaCl杂质,可用下列装置测定纯碱中碳酸钠的质量分数。如图所示,从D处鼓入空气,A试管盛有NaOH溶液,E是盛有稀硫酸的分液漏斗,B广口瓶中放的是含有NaCl杂质的Na2CO3固体,C为盛有浓硫酸的试管,F、G均为盛有碱石灰的干燥管。
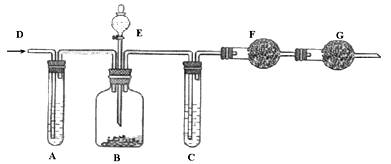
实验操作如下: ①检查装置的气密性;②在干燥管F内填满颗粒状碱石灰,其总质量为m1 g;③称取一定量的纯碱样品m2 g,并放入广口瓶中;④从分液漏斗中缓慢的滴入稀硫酸,至不再产生气体为止;⑤从D处缓慢鼓入空气数分钟,然后再称量干燥管F,其总
质量为m3 g。回答下列问题:
(1)鼓入空气的目的是_____________________________________________。
(2)装置G的作用是_______________________________________________。
(3)装置A的作用是_______________________________________________。
(4)装置C的作用是_______________________________________________。
(5)样品中碳酸钠的质量分数计算式为_______________________________。
(6)如撤去装置A,则将导致实验结果___。(填“偏大”、“偏小”或“不变”)
(7)如撤去装置C,则将导致实验结果______。(填“偏大”、“偏小”或“不变”)
(8)上述实验操作中的④和⑤,都要求实验缓慢进行。如果这两步操作太快,则将导致实验结果__________________。(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g); ΔH<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图曲线(II)所示:
2HI(g); ΔH<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图曲线(II)所示:
(1)达平衡时,I2(g)的物质的量浓度为 mol?L-1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(I)所示,则该条件可能是 (填入下列条件的序号)。

①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和
c mol HI(g)(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系为 (用一个含a、b、c的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
如下图所示,A、B、C、D、E五种物质的相互转化关系

请回答:
(1)若A通常状态下为固态单质,A→E分别为(写化学式)A ;B ;
C ;D ;E 。
(2)若A通常状态下为气态单质,则A→E分别为(写化学式)A ;B ;C ;D ;E 。
查看答案和解析>>
科目: 来源: 题型:
下表是元素周期表的一部分。
| 族 | ⅠA | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑾ | ⑿ | ⒀ | ||||
(1)表中元素______的非金属性最强;元素______的金属性最强; (填写元素符号);
(2)表中元素③⑨组成的物质,分子内含有________键(填极性或非极性,下同),其分子为_______分子;
(3)表中元素⑥⑩⒀氢化物的稳定性顺序为_____>_____>_____(填写化学式,下同);
(4)用电子式表示表中⑧⑩两元素形成化合物的过程____________________________。
查看答案和解析>>
科目: 来源: 题型:
25℃、101KPa时,1g甲醇完全燃烧生成CO2和H2O,同时放出22.68KJ热量。下列表示该反应的热化学方程式中正确的是( )
A.2CH4O(l)+ 3O2(g)==2CO2(g)+4H2O(l) △H=-22.68KJ/mol
B.2CH4O(l)+ 3O2(g)==2CO2(g)+4H2O(l) △H=+1451.6KJ/mol
C.CH4O(l)+ 3/2 O2(g)==CO2(g)+2H2O(l) △H=-725.8KJ/mol
D.CH4O(l)+ 3/2 O2(g)==CO2(g)+2H2O(g) △H=-725.8KJ/mol
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为34。E原子半径是短周期元素原子半径最大的。则下列叙述正确的是( )
A.A和C能形成共价化合物
B.由B、D原子构成的分子的结构是正四面体
C.E和C只能形成E2C 一种化合物
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是:( )
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,14g氮气含有的核外电子数为5NA
C.标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式中,表达正确的是 ( )
A.向 NaHS 溶液中通入适量氯气:HS+Cl2 =S↓+H++2Cl
B.向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.将 10 mL 0.1 mol•L-l HCl溶液与20 mL 0.05 mol•L-l Na3PO4 溶液混合
3H++2 PO43= H2PO4+HPO42
D.向 Mg(HCO3)2溶液中加入过量NaOH 溶液
Mg2++2HCO3+2OH=MgCO3↓+CO32+2H2O
查看答案和解析>>
科目: 来源: 题型:
巴豆酸的结构简式为CH3CH=CHCOOH ,现有①水;②溴的四氯化碳溶液;③乙醇;④纯碱溶液;⑤酸性KMnO4溶液,在一定条件下,能与巴豆酸反应的物质组合是( )
A.只有②④⑤ B.只有②③⑤ C.只有②③④⑤ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com