
科目: 来源: 题型:
北京2008奥运会金牌为金镶玉,直径为70mm,厚6mm。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来证明甲、乙、丙猜想的正误,该试剂应是( )
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
查看答案和解析>>
科目: 来源: 题型:
科学家最近发现两种粒子:第一种是由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是 ( )
A.“四中子”的粒子不显电性
B.“四中子”的质量数为4
C.第二种粒子是氧元素的另一种同位素
D.第二种粒子的化学式为O4
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1 :2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);
(3)C分子中都包含_______个σ键,_______个π键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
_____________________________________________________________________。
II.CO的结构可表示为C≡O,N2的结构可表示为N≡N。
(5)下表是两者的键能数据:(单位:kJ/mol)
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:__________________________________________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为 __ ____ ,基态Cu原子的价电子排布式为___________________________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型)。
查看答案和解析>>
科目: 来源: 题型:

塑料是常用的合成高分子材料,常用塑料F、G均可由某烃经下列反应得到:
(1)写出反应①的化学方程式:_________ _________________________;
(2)写出反应②的化学方程式:_________ _________________________;
(3)写出反应③的化学方程式:_________ _________________________;
查看答案和解析>>
科目: 来源: 题型:
相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现B的氢谱如下:
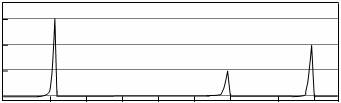
B的结构简式为:___________________________________。
查看答案和解析>>
科目: 来源: 题型:
在下图所示的转化关系中,括号内编号①―④表示转化所需化学试剂:

(1)用化学式填空:
①是 、②是 、
③是 、④是 、
(2)A的结构简式是 。
(3)反应④的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
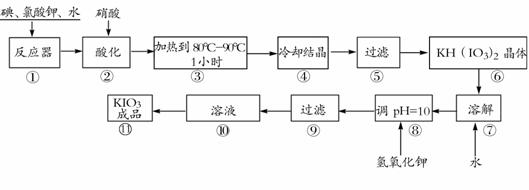
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的操作方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目: 来源: 题型:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
□SiO2+□C+□N2![]() □Si3N4+□CO
□Si3N4+□CO
(1) 配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是__________,其还原产物是_____________。
(3)该反应的平衡常数表达式为K =_______________________;
(4)将知上述反应为放热反应,则其反应热DH________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值________(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向_______反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v (CO) =18 mol/(L?min),则N2消耗速率为v (N2) =_________mol/(L?min)。
查看答案和解析>>
科目: 来源: 题型:
如图已知:

①单质E可作为半导体材料;
②化合物F是不能生成盐的氧化物;
③化合物I能溶于水呈酸性,它能够与化合物A反应。据此,请填空:
(1)化合物F的化学式为 。
(2)化合物I的名称是 。
(3)反应③的化学方程式为 。
(4)反应④的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com