
科目: 来源: 题型:
(8分)将Cu与Fe2O3的混合粉末ag与1mol/L硫酸进行反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中无Fe3+,则a= ,混合粉末中铜的质量为 。
(2)若将固体完全溶解于1.00L硫酸中,测得c(Fe3+)=0.1mol/l(假设反应前后溶液的体积不变),则混合粉末中铜的质量的最大值为 g。
(3)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中既有Fe3+,也有Fe2+,则a的取值范围是 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(14分)I 选择下列实验方法分离物质,将分离方法的序号依次为
①分离水和四氯化碳的混合物;②分离氯化钾溶液和沙子的混合物;
③从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
④ 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
⑤分离食盐和碘的混合物; ⑥ 从碘水中提取碘单质。
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华
II 、长期存放在Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。
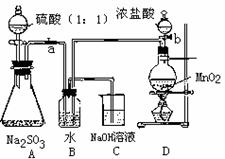
请回答:(1)写出B装置中反应的离子方程式
(2)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(3)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
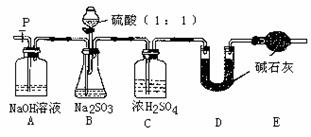
(4)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(5)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(6)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量盐酸,再加足量Ba(NO3)2溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将滤液蒸干,称量得固体m3g
D.将样品溶液,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
查看答案和解析>>
科目: 来源: 题型:
(14分)
A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:

(1)G中含有的官能团名称: ④的反应类型 ,⑥的反应类型 。
(2)B和C均为有支链的有机化合物,B的结构简式为 ;D的结构简式为 。
(3)写出⑤的化学反应方程式 。
⑨的化学反应方程式 。
(4)与H具有相同官能团的H的同分异构体有 种。
查看答案和解析>>
科目: 来源: 题型:
(12分)以惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。

回答下列问题: (1)甲在元素周期表中位置是 ;
(2)若电解的是NaCl溶液:
①A与B反应的离子方程式是
②若电解100mL0.1mol•L-1NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)
(3)若电解的是CuSO4溶液:
①E的化学式是 ;电解时阳极的电极反应式是 ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是 。
 |
③若利用反应A+B+C―→CuSO4+H2O,把化学能转化为电能,所设计电池的负极材料是 (填元素符号)。
查看答案和解析>>
科目: 来源: 题型:
(12分)由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如下图(其他无关物质已略去)。请回答下列问题:
| 单质X2 | 标准状况下密度为3.17 g?L-1 |
| 单质Y | 通常状况下为一种淡黄色固体 |
| 化合物Z | 焰色反应呈紫色(透过蓝色钴玻璃观察) |
| 常温下0.1 mol?L-1 Z的水溶液pH=13 |
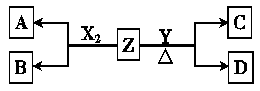
(1) Z的电子式为 。
(2)已知16 g固态单质Y在空气中完全燃烧放出148 kJ热量,则该反应的热化学方程式为 。
(3)已知C能与稀硫酸反应生成能使品红溶液褪色的气体,D中所含阴、阳离子的电子层排布相同。
①常温下D的水溶液pH>7,其原因是(用离子方程式表示) 。
②将20 mL 0.5 mol?L-1 C溶液逐滴加入20 mL 0.2 mol?L-1 KMnO4溶液(硫酸酸化)中,溶液恰好变为无色。写出该反应的离子方程式: 。
(4)①用石墨和铁作电极,在隔膜电解槽中电解A的溶液,阳极产生X2,电解A溶液的离子方程式为 。
②实验室常用含X元素的一种化合物E制取O2 ,工业上用无隔膜电解槽(石墨和铁作电极,温度为42~44 ℃)电解A的溶液生产化合物E。假设电解时电解槽进液口溶液中A 的浓度为2 mol?L-1,液口溶液中A的浓度为1.6 mol?L-1(进出口流量相同),则液口溶液中E的浓度为
mol?L-1。
查看答案和解析>>
科目: 来源: 题型:
铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):![]()
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
经由计算分析,下列推断正确的是 ( )![]()
A.①中溶解了5.6 g Fe B.硝酸的浓度为4 mol/L
C.②中溶解了9.6 g Cu D.④中V = 6720![]()
查看答案和解析>>
科目: 来源: 题型:
向某密闭容器中加人0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~tl阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂。下列说法中不正确的是
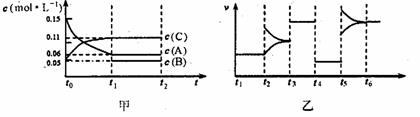
A.若tl=15s,则用C的浓度变化表示的t0~tl段的平均反应速率为0.004mol?L-1?s-1
B.以t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L, B的起始物质的量为0.02mo1.
D.t5~t6阶段,容器内A的物质的量减少了0.03mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为:3A(g)![]() B(g) + 2C(g);△H =+100a kJ?mo1-1
B(g) + 2C(g);△H =+100a kJ?mo1-1
查看答案和解析>>
科目: 来源: 题型:
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):![]() 学科网
学科网

![]()
则下列分析都正确的组合是 ( )
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 | |
| A | NaHCO3 | I | c(Na+) = c(HCO3-) |
| B | NaHCO3、Na2CO3 | Ⅱ | c(CO32-) < c(HCO3-) |
| C | NaOH、Na2CO3 | Ⅲ | c(OH-) > c(CO32-) |
| D | Na2CO3 | Ⅳ | c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:
电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( )
A.0.10 mol/L Ag+ B.0.20 mol/L Zn2+
C.0.20 mol/L Cu2+ D.0.20 mol/L Pb2+
查看答案和解析>>
科目: 来源: 题型:
已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2878K/mol
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2869kJ/mol
![]() 下列说法正确的是
下列说法正确的是
![]() A、正丁烷分子储存的能量大于异丁烷分子
A、正丁烷分子储存的能量大于异丁烷分子
![]() B、正丁烷的稳定性大于异丁烷
B、正丁烷的稳定性大于异丁烷
![]() C、异丁烷转化为正丁烷的过程是一个放热过程
C、异丁烷转化为正丁烷的过程是一个放热过程
![]() D、异丁烷分子中的碳氢键比正丁烷的多
D、异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com