
科目: 来源: 题型:
在密闭容器中进行下列反应:M(g)+N(g)![]() R(g)+2L,此反应符合下面图像,下列叙
R(g)+2L,此反应符合下面图像,下列叙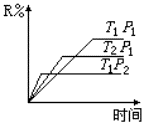 述正确的是
述正确的是
A. 正反应吸热,L是气体
B. 正反应吸热,L是固体
C. 正反应放热,L是气体
D. 正反应放热,L是固体或液体
查看答案和解析>>
科目: 来源: 题型:
温度一定时, 于密闭容器中发生可逆反应: mA(气) + nB(气) ![]() pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是
A. 平衡向逆反应方向移动 B. C气体的体积分数增大
C. 气体A的转化率升高 D. m + n > p
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中进行化学反应:2SO2 + O2![]() 2SO3。已知反应过程中某一时刻SO2、O2、SO3浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时可能存在的数据是
2SO3。已知反应过程中某一时刻SO2、O2、SO3浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时可能存在的数据是
A、SO2为0.4mol/L、O2为0.2mol/L B、SO2为0.25mol/L
C、SO2、SO3都为0.15mol/L D、SO2为0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
在一定的温度下,向0.2mol/LCH3COOH的溶液里加水稀释,下列各种量的变化中,变大的是①c(H+)的物质的量浓度 ②c(OH--)的物质的量浓度 ③c (CH3COO--)/c(CH3COOH) ④c(H+)?c(OH--)
A .① ④ B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目: 来源: 题型:
将氨水缓缓地滴入盐酸中至中性,下列有关的说法中正确的是:①盐酸过量 ②氨水过量 ③ 恰好完全反应 ④ c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-)
A. ①⑤ B. ③④ C. ②⑤ D. ②④
查看答案和解析>>
科目: 来源: 题型:
关于溶液的酸性、酸性强弱的说法中,正确的是
A. 只要溶液里有H+,溶液就显酸性
B. H+浓度增大,溶液的酸性一定增强
C. H+浓度大于OH--浓度,溶液一定显酸性
D. 强酸溶液的酸性一定比弱酸溶液的酸性强
查看答案和解析>>
科目: 来源: 题型:
将含有C.H、O的有机物4.88 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了12.32g。已知该有机物的相对分子质量为122。
⑴燃烧此有机物4.88g,须消耗氧气的质量是多少?
⑵通过计算确定该有机物的分子式?
⑶如果该有机物1个分子中存在1个苯环和1个侧链,试写出它的所有同分异构体的结构简式。
查看答案和解析>>
科目: 来源: 题型:
从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
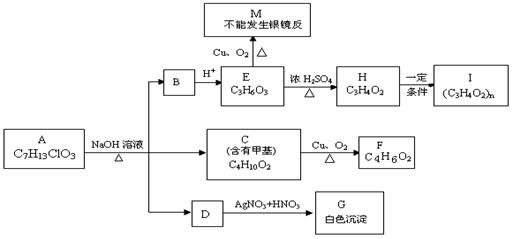
(1)A的结构简式: ;
(2)写出反应类型: E→H 、H→I ;
(3)写出C→F的化学方程式: 。
(4)请设计出由丙烯合成CH3―CH(OH)―COOH的反应流程图(有机物用结构简式表示,必须注明反应条件)。
![]()
![]()
![]() 提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:
B C …… G
查看答案和解析>>
科目: 来源: 题型:
有机物X( )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
(1)有机物中含有的官能团名称是 ;在一定条件下有机物X可发生化学反应的类型有 (填序号);
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应
(2)下列物质与X互为同分异构体的是 (填序号);
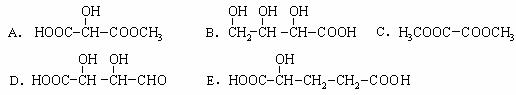 |
(3)写出X与金属钠发生反应的化学方程式: ;
(4)写出X与氧气在铜作催化剂加热的条件下发生反应所得的可能产物的结构简式 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)航天技术上使用的氢―氧燃料电池具有高能、轻便和不污染环境等优点。氢―氧燃料电池有酸式和碱式两种,它们放电时的电池总反应为: 2H2 + O2 = 2 H2O 。酸式氢―氧燃料电池的电解质是酸,其负极反应可表示为: 2H2 4e- = 4 H+,其正极反应表示为___________ ;碱式氢―氧燃料电池中的电解质是碱,其正极反应表示为: O2 +2H2O+4e-=4OH-,则其负极反应可表示为:
(2)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,正极板上覆盖PbO2,
负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是__________________________
充电时:阴极的电极反应式是
(3)现代工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请
回答下列问题:
①该过程总的离子反应方程式为:
电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使
用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸, 其合理的加入顺序为
_________________(填试剂序号)。
②离子交换膜的作用是 。
 ③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的功能――只允许阳
离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它只
允许阴离子通过,可阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4
溶液,通电电解。阴极的电极反应式为_____________________________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com