
科目: 来源: 题型:
化学反应N2+3H2![]() 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
2NH3的能量变化如下图所示,该反应的热化学方程式是( )
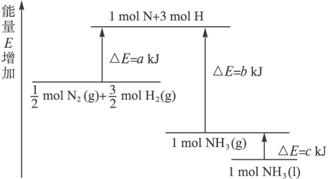
A.N2(g)+3H2(g)![]() 2NH3(l);ΔH=2(a-b-c)kJ?mol-1
2NH3(l);ΔH=2(a-b-c)kJ?mol-1
B.N2(g)+3H2(g)![]() 2NH3(g);ΔH=2(b-a)kJ?mol-1
2NH3(g);ΔH=2(b-a)kJ?mol-1
C.![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(l);ΔH=(b+c-a)kJ?mol-1
NH3(l);ΔH=(b+c-a)kJ?mol-1
D.![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g);ΔH=(a+b)kJ?mol-1
NH3(g);ΔH=(a+b)kJ?mol-1
查看答案和解析>>
科目: 来源: 题型:
(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3。在该反应的化学方程式中,化学计量数由小到大的产物分子依次是
A.SO2、H2O、N2、NH3 B.N2、SO2、H2O、NH3
C.N2、SO2、NH3、H2O D.H2O、NH3、SO2、N2
查看答案和解析>>
科目: 来源: 题型:
已知:H2(g)+F2(g)![]() 2HF(g)+270 kJ,下列说法正确的是( )
2HF(g)+270 kJ,下列说法正确的是( )
A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是( )
A.石灰乳与Na2CO3溶液混合:Ca2++![]()
![]() CaCO3↓
CaCO3↓
B.NH4HSO3溶液与足量NaOH溶液混合加热:
![]() +
+![]() +2OH-
+2OH-![]() NH3↑+
NH3↑+![]() +2H2O
+2H2O
C.酸性条件下KIO3溶液与KI溶液反应生成I2:
![]() +5I-+3H2O
+5I-+3H2O![]() 3I2+6OH-
3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3?H2O![]() AgOH↓+
AgOH↓+![]()
查看答案和解析>>
科目: 来源: 题型:
下列各组离子一定能大量共存的是( )
A.在含有大量[Al(OH)4]-的溶液中:![]() 、Na+、Cl-、H+
、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、![]() 、
、![]()
C.在pH=12的溶液中:![]() 、Na+、
、Na+、![]() 、Cl-
、Cl-
D.在c(H+)=0.1 mol?L-1的溶液中:K+、I-、Cl-、![]()
查看答案和解析>>
科目: 来源: 题型:
下列各组离子在给定条件下能大量共存的是( )
A.在pH=1的溶液中:![]() 、K+、ClO-、Cl-
、K+、ClO-、Cl-
B.有![]() 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有![]() 存在的强酸性溶液中:
存在的强酸性溶液中:![]() 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.在C(H+)=1.0×10-13 mol?L-1的溶液中:Na+、S2-、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
氮元素是生命活动、物质间转化的常见元素。
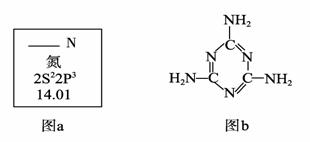
(1)图a是元素周期表中N元素的有关信息,图a中横线上缺失的具体内容是 。
15N是N元素的一种重要核素,其一个原子核中含有的中子数为 。
(2)三聚氰胺的结构简式如上图b,根据你的了解,下列关于三聚氰胺的表述中,
正确的是 (填字母序号)。
A.三聚氰胺的熔点可能很高 B.三聚氰胺的含氮量高达67%左右
C.三聚氰胺属于无机化合物 D.三聚氰胺分子中所有原子在同一平面上
(3)①最近科学家们合成了由氮元素形成的N5n+,电子式![]() 为
为
则n值为 。
②H与N能形成化合物NH5 ,已知该物质与水反应有H2生成,则NH5中含有的化学键为 。
(4)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为
35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。

①写出D与X反应的化学方程式
②写出G与H反应的离子方程式 。
③实验室中I应如何保存? 。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式 。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
查看答案和解析>>
科目: 来源: 题型:
现有四种短周期元素X、Y、Z、W,其中:① X、W原子的电子层数与最外层电子数之比分别为3:1和 1:3 ② Y元素的某原子核内无中子 ③ Z元素原子的最外层电子数是其内层电子总数的2倍。回答下列问题:
(1)X元素在周期表中的位置是 。
(2)上述四种元素中,只由一种元素的原子构成的常见离子是
(填离子符号)。
(3)化合物X2W2的电子式是 。
(4) 向含1 mol Na2SiO3的溶液中缓慢通入2 mol的ZO2,反应的离子方程式是 。
(5)由Y、Z、W元素中的两种或三种可以组成多种分子,其中 含有18个电子的分子是
(填化学式)。
(6)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向25.00 mL 的Y2Z2W4溶液中加入5.00 mL 0.50 mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
查看答案和解析>>
科目: 来源: 题型:阅读理解
下表中的实线表示元素周期表部分边界。途中的字母分别表示元素周期表中对应位置的元素。

(1)请在上面的元素周期表中用实线画出周期表未完成的边界。
(2)表中字母对应的元素中,非金属性最强的元素的名称是 ,请用一个化学方程式表示出该元素的非金属性比e对应元素强 。
(3)第三周期的8种元素按单质熔点大小
顺序的柱形图如右所示,
其中序列“8”所对应元素的元素符号是 。
(4)现有b、d、h三种元素的氢化物,其中沸点最高的氢化物的空间构型是 。
(5)i对应的元素的最高价氧化物对应水化物的电离方程式为 。
Ⅱ、(5分)现有下列短周期元素的性质数据:
编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(10-10) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
试回答下列问题:
(1)上述元素中处于第ⅤA族的有 ,处于第二周期的有
(以上均用编号回答)
(2)上述元素中金属性最强的是 (用编号回答)
(3)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)
即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于或等于
原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素。试回答:
a、第n(n≥2)周期有 种非金属元素(含零族元素)
b、根据周期表中每个周期非金属元素的种数(含零族元素),预测目前的周期表若填满后还有 种非金属元素未被发现。
查看答案和解析>>
科目: 来源: 题型:
已知氧元素有16O、18O两种核素,按中学化学知识要求,下列说法正确的是 ( )
A.Na2O2与H218O反应时生成产生18O2气体
B.向2SO2(g)+O2(g) ![]() 2SO3(g)的平衡体系中加入18?O2,结果18?O2
2SO3(g)的平衡体系中加入18?O2,结果18?O2
只出现在产物中
C.CH?3?COOH和CH3CH?218?OH发生酯化反应时,产物中分子式为H218?O
D.用惰性电极电解含有H218?O的普通水时,阳极可能产生三种相对分子质量不同的氧分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com