
科目: 来源: 题型:
下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18个元素
C.副族元素中没有非金属元素
D.碱金属元素是指IA族的所有元素
查看答案和解析>>
科目: 来源: 题型:
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
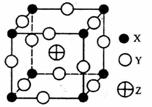
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
查看答案和解析>>
科目: 来源: 题型:
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和![]() 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:

回答下列问题:
(1)滤渣的主要成分为________________。
(2)“趁热过滤”的原因是________________________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是_______________________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_____________________________。
(5)已知:Na2CO3?10H2O(s)![]() Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ?mol-1
Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ?mol-1
Na2CO3?10H2O(s)![]() Na2CO3?H2O(s)+9H2O(g) ΔH2=+473.63 kJ?mol-1
Na2CO3?H2O(s)+9H2O(g) ΔH2=+473.63 kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。
![]()
(2)反应中,被还原的元素是_________,还原剂是____________。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
![]()
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为_____________。
查看答案和解析>>
科目: 来源: 题型:
(1)配平氧化还原反应方程式:
![]()
![]() +
+![]()
![]() +
+![]() H+
H+![]() CO2↑+
CO2↑+![]() Mn2++
Mn2++![]() H2O
H2O
(2)称取6.0 g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol?L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___________________mol。
②第二份溶液中滴加0.10 mol?L-1酸性KMnO4溶液至16 mL时反应完全,此时溶液颜色由_____________变为___________。该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4?2H2O的质量分数为__________,KHC2O4的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)![]() 4CO(g) + BaS(s) △H1 = 571.2 kJ?mol-1 ①
4CO(g) + BaS(s) △H1 = 571.2 kJ?mol-1 ①
BaSO4(s) + 2C(s)![]() 2CO2(g) + BaS(s) △H2= 226.2 kJ?mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ?mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g)![]() 2CO(g)的△H= kJ?mol-1。
2CO(g)的△H= kJ?mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 , 。
查看答案和解析>>
科目: 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
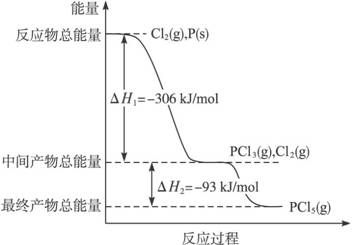
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2 α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________
(4)P和Cl2分两步反应生成1mol PCl5的△H3=____________,P和Cl2一步反应生成1molPCl5的△H4__________△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
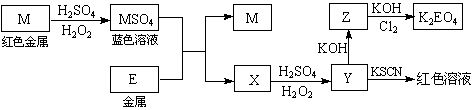
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
⑷由E制备的E(C2H5)2的结构如下图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:![]() 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。

查看答案和解析>>
科目: 来源: 题型:
某钠盐溶液可能含有阴离子![]() ,
,![]() ,
,![]() ,
,![]() ,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下实验:
,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验① ;
实验② ;
实验③ ;
实验④ ;
实验⑤ ;
(2)上述5个实验不能确定是否存在的离子是 。
查看答案和解析>>
科目: 来源: 题型:
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)![]() CH4(g)+HC≡CH(g)+H2(g) △H1=156.6 kJ?mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=156.6 kJ?mol-1
CH3CH=CH2(g)![]() CH4(g)+HC≡CH(g) △H2=32.4 kJ?mol-1
CH4(g)+HC≡CH(g) △H2=32.4 kJ?mol-1
则相同条件下,反应C3H3(g)![]() CH3CH=CH2(g)+H2(g)的△H=_____kJ?mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ?mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,![]() 移向电池的_______(填“正”或“负”)极。
移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]()
![]() +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol?L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(![]() )(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com