
科目: 来源: 题型:
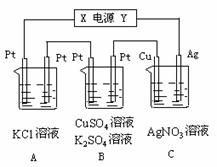
下图中甲、乙两个装置用导线连接,有关叙述正确的是( )![]()
![]()

![]() A.甲装置中Cu为阳极,乙装置Fe为负极
A.甲装置中Cu为阳极,乙装置Fe为负极![]()
B.甲装置中SO2-4向Cu极移动,乙装置中的Na+向石墨极移动![]()
C.乙烧杯中Fe极的电极反应式为:2H2O+2e-=2OH-+H2↑![]()
D.当石墨电极上产生11.2L(标准状况)气体时,消耗Zn的质量为65g![]()
查看答案和解析>>
科目: 来源: 题型:
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g, 乙池中某电极上析出0.24g某金属,下列说法正确的是( )
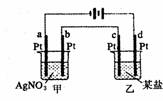
A.甲池是b极上析出金属银,乙池是c极上析出某金属
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
查看答案和解析>>
科目: 来源: 题型:
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
A.产生气体体积 ①=②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑②中负极:2H++2e-=H2↑
D.溶液的pH变化:①减小,②增大
查看答案和解析>>
科目: 来源: 题型:
下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是( )
A.装置中的离子交换膜只能让阳离子通过,不能让阴离子通过
B.装置中出口①处的物质是氢气,出口②处的物质是氯气
C.除去杂质后的氢氧化钠溶液从出口B处导出
D.转移电子0.8 mol时产生氢气8.96 L(标准状态)
查看答案和解析>>
科目: 来源: 题型:
下列有关水的电解实验的说法中不正确的是( )
A.为提高水的电解速率,可以在水中加入少量的氯化钠
B.若在水中加入少量的硫酸钠,电解结束后溶液的pH将会保持不变
C.电解过程中,阴极区附近的溶液会使酚酞试液变红
D.当电解产生氧气1.12 L(标准状况)时,转移的电子总数为0.2mol
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目: 来源: 题型:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:
(1)电源电极X名称为___________;
(2)pH变化:A___________________、 B________________、C_______________;
(3)通电5min时,B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
如图为相互串联的甲乙两个电解池,请回答:

(1)甲池若为用电解原理精炼铜的装置,A极是_________极,材料是___________,电极反应为____________________________;B极是_______极,材料是_______________,电极反应为______________________________,电解质溶液为______________。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈____色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积为______。
(4)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为________________
查看答案和解析>>
科目: 来源: 题型:
将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe → Cu | +0.78 |
| Zn | Zn → Cu | +1.10 |
| A | Cu → A | +0.15 |
| B | B → Cu | +0.3 |
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越 (填“大”、“小”)。Zn、A、B三种金属活动性由强到弱的顺序是 。
(2)Cu与A组成的原电池, 为负极,此电极反应式为______________
(3)A、B形成合金,露置在潮湿空气中, 先被腐蚀。
查看答案和解析>>
科目: 来源: 题型:
(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) H1 =+ 67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g) H2=- 534kJ/mol
试写出N2H4与 NO2反应的热化学方程式 ____________
(2)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式_______________________ __________ 。
若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) == H2O(l)的
△H=______________ kJ?![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com