
科目: 来源: 题型:
下列有关氧化还原反应的叙述正确的是 ( )
A.肯定有一种元素被氧化,另一种元素被还原
B.在氧化还原反应中不一定所有元素的化合价都发生变化
C.在氧化还原反应中最多有两种元素化合价发生升降
D.四种基本反应中只有置换反应属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
关于氧化还原反应的叙述中不正确的是 ( )
A. 在反应中得电子的元素一定被还原
B. 在反应中元素化合价有升高一定有降低
C. 在反应中元素化合价升高一定失去电子
D.有单质参加或生成的反应一般是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
某物质中元素被氧化,则该元素一定是 ( )
①化合价升高;②化合价降低;③得到电子或电子对偏向;④失去电子或电子对偏离
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目: 来源: 题型:
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:
![]() 2NO+2CO
2NO+2CO![]() 2CO2+N2。
2CO2+N2。
![]()
![]() 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10 -3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
![]() 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
![]()
![]() (1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
![]()
![]() (2)前2s内的平均反应速率v(N2)= 。
(2)前2s内的平均反应速率v(N2)= 。
![]()
![]() (3)在该温度下,反应的平衡常数K= 。
(3)在该温度下,反应的平衡常数K= 。
![]()
![]() (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
![]()
![]() A.选用更有效的催化剂 B.升高反应体系的温度
A.选用更有效的催化剂 B.升高反应体系的温度
![]() C.降低反应体系的温度 D.缩小容器的体积
C.降低反应体系的温度 D.缩小容器的体积
![]()
查看答案和解析>>
科目: 来源: 题型:
有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA,1molB分别同时混合于a、b两容器中,
![]() 发生反应 3A(g )+B(g)
发生反应 3A(g )+B(g) ![]() 2C(g)+D(g)
2C(g)+D(g)
![]()
![]() (1)达平衡时,a中A的浓度为M mol?L-1,C的浓度为N mol?L-1,b中A的浓度为
(1)达平衡时,a中A的浓度为M mol?L-1,C的浓度为N mol?L-1,b中A的浓度为
![]() m mol?L-1,C的浓度为n mol?L-1,则M m;N n;
m mol?L-1,C的浓度为n mol?L-1,则M m;N n;
![]() (填>、<、=、无法比较)
(填>、<、=、无法比较)
![]()
![]() (2) 保持温度不变,按下列配比分别充入 a 、b 两容器,达平衡后a中c 的浓度为N mol?L- 1的是( ),b中c的浓度为n mol?L-1的是( )
(2) 保持温度不变,按下列配比分别充入 a 、b 两容器,达平衡后a中c 的浓度为N mol?L- 1的是( ),b中c的浓度为n mol?L-1的是( )
![]() A.6molA+2molB B.3molA+2molC C.2molC+1molB+1mol D
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1mol D
![]() D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
![]()
![]() (3)若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为Wmol?L-1,C的浓度为Ymol?L-1,则W和M,Y和N之间的关系为W M、Y N.
(3)若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为Wmol?L-1,C的浓度为Ymol?L-1,则W和M,Y和N之间的关系为W M、Y N.
![]() (填>、<、=、无法比较)
(填>、<、=、无法比较)
![]() (4)保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为Rmol?L-1则 ( )
(4)保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为Rmol?L-1则 ( )
![]() A.R=2M B.R<M C.M<R<2M D.R>2M
A.R=2M B.R<M C.M<R<2M D.R>2M
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
现在城市居民使用的管道煤气的主要成分是H2、CO和少量CH4。H2、CO和CH4的燃烧热数据如下表![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
物质 | H2 | CO | CH4 |
燃烧热(kJ?mol-1) | 285.8 | 283.0 | 890.3 |
(1)请写出H2、CO和CH4燃烧的热化学方程式。
![]() _________________________________________________________________________;
_________________________________________________________________________;
![]() _________________________________________________________________________;
_________________________________________________________________________;
![]() _________________________________________________________________________。
_________________________________________________________________________。
![]()
![]() (2)作为开发西部的西气东输工程的重要成就,西部天然气已全面进入上海、江苏境内,陆续成为城市居民使用的主要能源。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____________(填“空气”或“天然气”)的进入量或减少_________(填“空气”或“天然气”)的进入量。
(2)作为开发西部的西气东输工程的重要成就,西部天然气已全面进入上海、江苏境内,陆续成为城市居民使用的主要能源。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大_____________(填“空气”或“天然气”)的进入量或减少_________(填“空气”或“天然气”)的进入量。
![]()
查看答案和解析>>
科目: 来源: 题型:
50 mL 0.50 mol?L-1盐酸与50 mL 0.55 mol?L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
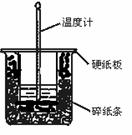
![]() (1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
![]() (2)烧杯间填满碎纸条的作用是 。
(2)烧杯间填满碎纸条的作用是 。
![]() (3)大烧杯上如不盖硬纸板,求得的中和热数值
(3)大烧杯上如不盖硬纸板,求得的中和热数值
![]() (填“偏大”“偏小”“无影响”)。
(填“偏大”“偏小”“无影响”)。
![]() (4)实验改用60 mL 0.50 mol? L-1盐酸跟50 mL 0.55 mol? L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理 由: 。
(4)实验改用60 mL 0.50 mol? L-1盐酸跟50 mL 0.55 mol? L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理 由: 。
![]() (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol?L-1NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol?L-1NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题
C(g)+D(g)过程中的能量变化如图所示,回答下列问题
![]()
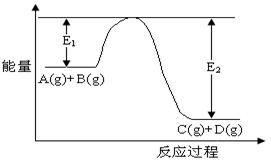
![]() (1)该反应是__________反应(填“吸热”“放热”);
(1)该反应是__________反应(填“吸热”“放热”);![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”“不变”),
![]() 原因是_____________________________________________________________________。
原因是_____________________________________________________________________。
![]() (3)反应体系中加入催化剂对反应热是否有影响?______________________,
(3)反应体系中加入催化剂对反应热是否有影响?______________________,
![]() 原因是_____________________________________________________________________;
原因是_____________________________________________________________________;
![]() (4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_______,E2_______(填“增大”“减小”“不变”)
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_______,E2_______(填“增大”“减小”“不变”)
![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com