
科目: 来源: 题型:
下列四种装置中,溶液的体积均为250毫升,开始时电解质溶液的浓度均为0.10摩/升,工作一段时间后,测得导线上均通过0.02摩电子,若不考虑溶液体积的变化,则下列叙述正确的是 ( )

A 工作一段时间后溶液的浓度①=②=③=④
B 工作一段时间后溶液的pH值:④>③>①>②
C 产生气体的总体积:④>③>①>②
D 电极上析出的固体的质量:①>②>③>④
查看答案和解析>>
科目: 来源: 题型:
将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,称为燃料电池。下列叙述中正确的是
①通人CH4的电极为正极;
②正极的电极反应式为:O2 + 2H2O + 4e ==== 4OH-
③通人CH4的电极反应式为:CH4+ 2O2+ 4e ==== CO2 +2H2O
④负极的电极反应式为:CH4+ 10 OH-- 8e ===== CO32- + 7H2O
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离于向负极移动。
⑦工作时正极区pH升高,负极区pH降低
A.①③⑤⑦ B.②④⑥⑦ C. ②④⑤⑥ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和不锈钢为电极,以KI溶液(加少量K2CrO4)为电解液在一定条件下电解,反应方程式为KI+3H2O![]() KIO3+3H2↑。下列有关说法正确的是 ( )
KIO3+3H2↑。下列有关说法正确的是 ( )
A 电解时,石墨作阴极,不锈钢作阳极
B 电解液调节至强酸性比较合适
C 电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D 电解中每转移0.6mol电子,理论上可得到21.4g无水KIO3晶体
查看答案和解析>>
科目: 来源: 题型:
将500 ml PH=5的硫酸铜溶液用惰性电极电解一段时间, 溶液PH变为2,若使溶液的浓度.PH与电解前相同,可采取的方法是
A 向溶液中加入0.245g Cu(OH)2 B 向溶液中加入0.31gCuCO3
C 向溶液中加入0.0025 molH2SO4 D 向溶液中加入0.2gCuO
查看答案和解析>>
科目: 来源: 题型:
用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,若电解前后温度变化忽略不计,下列有关溶液叙述正确的有
①该溶液的pH可能增大 ②该溶液的pH可能减小 ③该溶液的pH可能不变
④该溶液的浓度可能增大 ⑤该溶液的浓度可能不变
A.①②③④⑤ B.只有①②④⑤
C.只有①③⑤ D.只有②③④
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为
A X>Z>Y>M B X>Y>Z>M C M>Z>X>Y D X>Z>M>Y
查看答案和解析>>
科目: 来源: 题型:
美国《科学美国人》杂志在1971年7月刊登的“地球的能量资源”一文中提供了如下数据:
到达地球表面的太阳辐射能的几条主要去路
| 直接反射 | 52,000×109kJ?s-1 |
| 以热能方式离开地球 | 81,000×109kJ?s-1 |
| 水循环 | 40,000×109kJ?s-1 |
| 大气流动 | 370×109kJ?s-1 |
| 光合作用 | 40×109kJ?s-1 |
请选用以上数据计算:
(1)地球对太阳能的利用率约为 。
(2)通过光合作用,每年有 kJ的太阳能转化为化学能(每年按365天计算)。
(3)每年由绿色植物通过光合作用(6 CO2+6 H2O=C6H12O6+6 O2)为我们生存的环境除去二氧化碳的质量为A。试根据能量关系列出A的计算式。列式中缺少的数据用符号Q表示。
A= kg。所缺数据Q的化学含义为 。
查看答案和解析>>
科目: 来源: 题型:
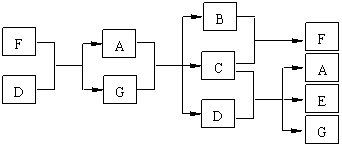 如图所示,已知G 、A分别是海水中含量最多的两种化合物,E是“84”消毒液的主要成分,请回答以下问题
如图所示,已知G 、A分别是海水中含量最多的两种化合物,E是“84”消毒液的主要成分,请回答以下问题
(1)写出C和E的电子式C 、E
(2)工业上通常采用电解熔融状态的A来制备时某种单质,写出电解的化学方程式
。
(3)工业上在电解A 、G 的混合物时,常用 做电极材料,电解的设备常用阳离子交换膜电解槽,阳离子交换膜的作用是
。
(4)阴极上的电极反应式为 ;若同时在两电极附近各滴入几滴酚酞试液,阴极附近观察到的现象是_______________________________;
阳极上的电极反应式为 ,检验该电极反应产物的方法是__________________________________________________________。
(5)C和G反应可以生成一种强酸和一种弱酸,写出化学反应方程式 。
该弱酸具有 性,常用于杀菌消毒。
查看答案和解析>>
科目: 来源: 题型:阅读理解
热力学是专门研究能量相互转变过程中所遵循的法则的一门科学。在热力学研究中,为了明确研究的对象,人为地将所注意的一部分物质或空间与其余的物质或空间分开。被划分出来作为研究对象的这一部分称之为体系;而体系以外的其他部分则称之为环境。热化学方程式中的H实际上是热力学中的一个物理量,叫做焓,在化学上表示一个封闭体系中化学反应的能量和对环境所作的功的和。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以 的形式体现的。
对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为 0(填“大于”、“小于”),该反应是 (填“放热”、“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH= 436 kJ?mol-1],形成化学键时ΔH<0[如2H(g)=H2(g) ΔH= - 436 kJ?mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ?mol-1
ΔH298(H2)= 436 kJ?mol-1 ,ΔH298(Cl2)= 247 kJ?mol-1
则ΔH298(HCl)= 。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH= -25 kJ?mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH= - 47 kJ?mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH= 19 kJ?mol-1
请写出CO还原FeO的热化学方程式:
。
查看答案和解析>>
科目: 来源: 题型:
已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气燃烧的热化学方程式 。
(2)若1 molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为 890 kJ( 填“>”、 “<”、“= ”)。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量(Q)的取值范围是 。
(4)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的的取值范围是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com